Белки соединительной ткани
В отличие от более мягких тканей, таких как мозг и печень, соединительная ткань представляет собой более прочный волокнистый материал, необходимый для механической функции организма. Волокнистые белки, составляющие внеклеточный матрикс ткани, определяют, будет ли она иметь структурную жесткость (кости), прочность на растяжение (сухожилия) или эластичность (кровеносные сосуды, кожа, легкие). Они встроены в аморфное основное вещество, состоящее из гиалуроновой кислоты, неволокнистых гликопротеинов и протеогликанов.Волокнистые белки
Коллаген и эластин представляют собой два основных волокнистых белка в соединительной ткани. Коллаген более распространен и составляет около 25% белка в организме. Он обнаруживается в тканях, обладающих прочностью на растяжение и жесткостью (например, сухожилия). Эластин, хотя и является волокнистым белком, подобным коллагену, выполняет функцию растяжения и отдачи в соединительных тканях (например, в артериальной стенке).Коллаген
Состав
Коллаген представляет собой длинную тройную спираль пептидных цепей, известных как α-цепи (рис. 1 a, b, c).
Рисунок 1. Тройная спираль пептидный альфа цепей
Каждый отдельный полипептид коллагена представляет собой α-цепь примерно из 1400 остатков. Каждая третья аминокислота представляет собой глицин (-Gly-X-Y-) с очень высокой долей пролина и лизина в двух других положениях. Многие остатки пролина и лизина гидроксилируются до гидроксипролина и гидроксилизина после синтеза α-цепи. Для реакций гидроксилирования требуются аскорбиновая кислота и железо (рис. 2). Чтобы упаковать три α-цепи в тройную спираль, повторяющийся глицин занимает одну сторону вдоль оси спирали. Отсутствие боковых цепей позволяет плотно упаковать α-цепи в тройной спиральный массив.

Рисунок 2. Пролил-4-гидроксилазы (C-P4H-I, C-P4H-II и C-P4H-III) ко- и посттрансляционно гидроксилируют остатки пролина в коллагенах в реакции, которая требует O 2 , 2-оксоглутарата, Fe++ и аскорбиновой кислоты
Классификация
Несколько разных типов или суперсемейств коллагена различаются по составу α-цепей, что определяет их функцию и, следовательно, их расположение. Например, коллаген типа I состоит из двух цепей α1 и одной цепи α2 (α12α2).- Коллаген типа I: обнаружен в большинстве соединительных тканей, включая кости (рис. 3).
- Коллаген типа II: содержится в хрящах и стекловидном теле.
- Коллаген типа III: обнаружен в коже, легких и кровеносных сосудах.
- Коллаген типа IV: находится в базальных мембранах и образует сети, собираясь в гибкую листовидную многослойную сеть.
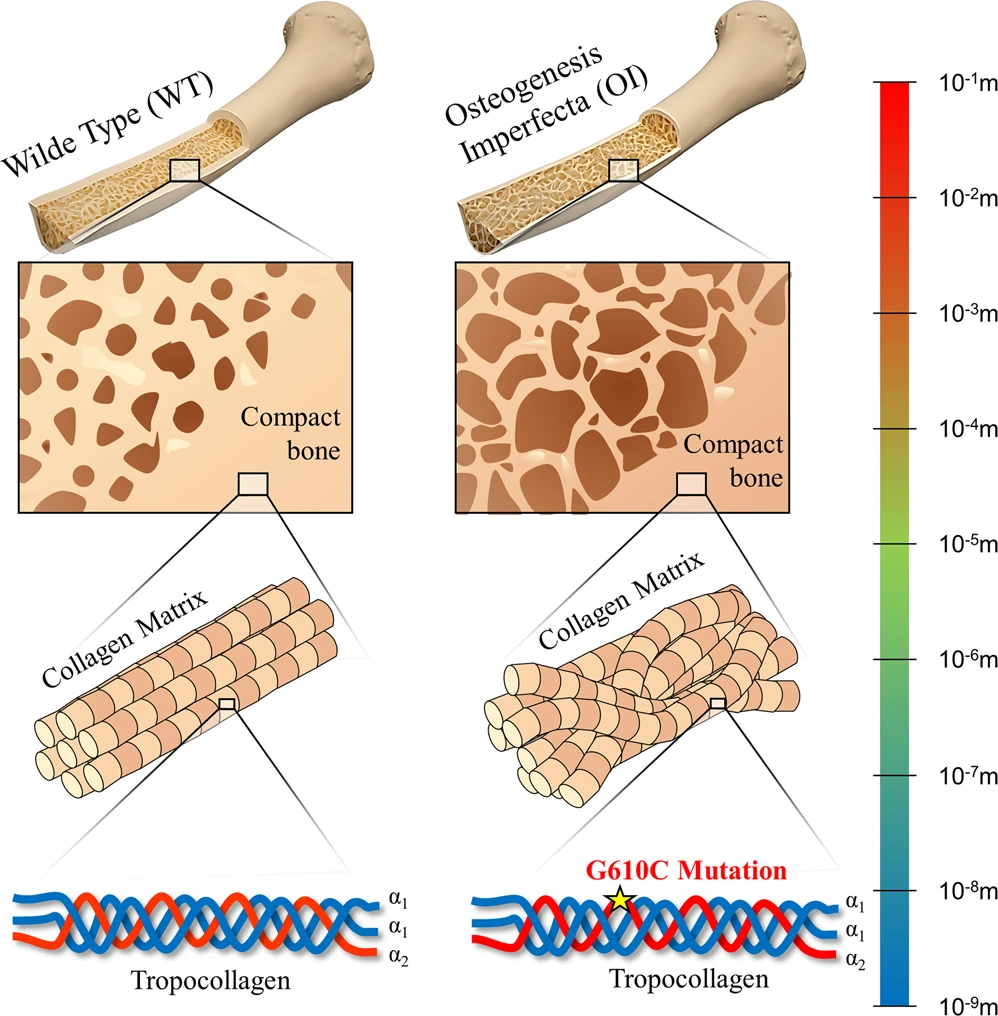
Рисунок 3. Коллаген 1 типа в костях
Синтез и деградация
Коллаген спонтанно собирается в фибриллы. Чтобы избежать преждевременной сборки волокон внутри клетки, синтезируется форма-предшественник — проколлаген. Синтез проколлагена включает (1) обширную посттрансляционную модификацию полипептида α-цепи и (2) сборку α-цепи в проколлаген (рис. 4).
Рисунок 4. Синтез проколлагена
α-цепь (препроколлаген) сначала направляется в эндоплазматический ретикулум (ЭР) с помощью сигнальной последовательности, которая немедленно удаляется в ЭР. Выбранные остатки пролина и лизина затем гидроксилируют в ER. Выбранные остатки гидроксилизина гликозилируются галактозилтрансферазой и глюкозилтрансферазой.
Про-α-цепи спонтанно собираются в тройные спирали проколлагена внутри ER. Полученная молекула имеет пропептидные удлинения на обоих концах, что по-прежнему предотвращает спонтанную сборку в коллагеновые фибриллы. Проколлаген перемещается из ЭПР в аппарат Гольджи и упаковывается в секреторные везикулы.
Проколлаген секретируется во внеклеточный матрикс путем экзоцитоза (слияния с плазматической мембраной), а проколлагеновые пептидазы удаляют концы пропептида. Затем проколлаген образует единицы, называемые тропоколлагеном, которые спонтанно собираются в коллагеновые фибриллы (см. рис. 5).

Рисунок 5. Синтез и самоорганизация коллагеновых фибрилл. (а) Фибробласты синтезируют предшественники коллагена в эндоплазматическом ретикулуме и секретируют их во внеклеточное пространство. (b) Многочисленные этапы образования коллагеновых фибрилл, включая синтез и химические модификации цепей проколлагена, их складывание в тройные спирали тропоколлагена и самоорганизацию в более крупные коллагеновые фибриллы. ( c ) Изображение коллагеновой фибриллы, полученное с помощью атомно-силовой микроскопии (АСМ), изображающее ее поперечнополосатую морфологию, полученную из ступенчатой укладки тройных спиралей тропоколлагена.
Коллагеновые фибриллы дополнительно укрепляются за счет образования поперечных связей между соседними боковыми цепями лизина ферментом лизилоксидазой. Это медленный, непрерывный процесс на протяжении всей жизни человека. Сшивание позволяет рубцовой ткани укрепляться в течение долгого времени после заживления раны, но также вызывает затвердевание коллагена, что способствует снижению эластичности сосудов с возрастом.
Коллаген можно реконструировать путем деградации металлопротеиназами. Действие этих пищеварительных ферментов уравновешивается тканевым ингибитором металлопротеиназ. У пациентов с остеоартритом наблюдается дисбаланс между металлопротеиназами и их тканевыми ингибиторами, что позволяет деградации преобладать над реконструкцией.
Заболевания, связанные с коллагеном
Причиной несовершенного остеогенеза являются нестабильные молекулы коллагена I типа. Они образуют аномальную матрицу и приводят к образованию ослабленных костей. Одна форма заболевания приводит к летальному исходу внутриутробно; при менее тяжелой форме у больного легко ломаются кости («ломкие кости») и замедляется заживление ран. Пациенты с менее тяжелым заболеванием, синдромом Элерса-Данлоса, имеют дефектные, плохо сшитые молекулы коллагена, что приводит к растяжению кожи и дряблости суставов.Эластин
Состав
Эластин подобен коллагену и также спонтанно собирается из мономеров (тропоэластин). Однако в тропоэластине гораздо меньше гидроксипролина и нет гидроксилизина, а содержание аланина и валина в нем высокое; это один из самых гидрофобных белков организма. Его эластичность является результатом деформируемости поперечных связей десмозина (рис. 6), которые образуют взаимосвязанную сеть фибрилл со свойствами каучука. Поперечные связи десмозина катализируются лизилоксидазой, тем же ферментом, который образует поперечные связи в коллагене.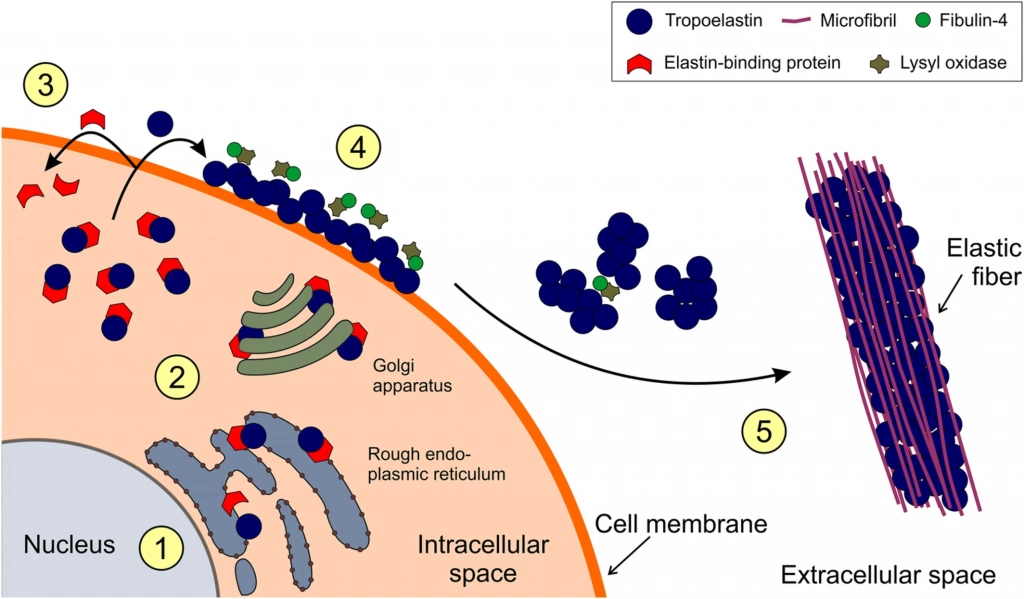
Рисунок 6. Схематическое изображение основных стадий сборки эластических волокон: (1) ТЕ синтезируется в шероховатой эндоплазматической сети, где он связывается с белком-шапероном EBP. (2) Комплекс EBP-TE транспортируется через аппарат Гольджи и секретируется на клеточную мембрану. (3) ТЭ высвобождается из-под шаперона и образует глобулы на клеточной поверхности, а ЭБП диссоциирует в результате взаимодействия с гликозаминогликанами и возвращается обратно в клетку. (4) Фибулин-4 важен для выравнивания цепи TE, опосредуя взаимодействие с лизилоксидазой или лизилоксидазоподобными ферментами. Окисление остатков лизина инициирует ряд реакций конденсации с образованием ковалентных внутри- и межмолекулярных поперечных связей. (5) После того, как кластеры молекул ТЭ достигают критического размера, они перемещаются из плазматической мембраны через ВКМ и агрегируют на каркасе микрофибрилл, в конечном итоге образуя эластичное волокно. EBP, эластин-связывающий белок; ECM, внеклеточный матрикс; ТЭ, тропоэластин
Заболевания, связанные с эластином
Разрушение эластина нейтрофилами привело бы к эмфиземе, если бы не α1-антитрипсин. Нейтрофилы патрулируют легкие, чтобы обнаруживать и бороться с внешними воздействиями. Одним из их видов оружия является эластаза, протеаза со специфичностью в отношении небольших гидрофобных остатков, таких как аланин и валин. Однако, если ее не остановить, эластаза также будет переваривать эластин в альвеолярных стенках, вызывая их разрушение, создавая увеличенные альвеолы с уменьшенной площадью поверхности; это состояние известно как эмфизема.Это повреждение легких предотвращается ингибитором протеиназы α1-антитрипсином (также называемым α1-антипротеазой из-за его широкой специфичности), который присутствует в крови (и повышен во время инфекций). Пациенты с наследственными дефектами α1-антитрипсина подвергаются серьезному риску развития эмфиземы; внутривенное введение α1-антитрипсина является эффективным методом лечения. Курение также может вызвать эмфизему, поскольку остаток метионина в α1-антитрипсине, необходимый для связывания с эластазой, уязвим для окисления сигаретным дымом.
Аморфное основное вещество
Аморфное «основное вещество» участвует в когезии тканей, взаимодействуя как с волокнами соединительной ткани, так и с клеточными поверхностями. Основное вещество также является гибким, что способствует упругости и деформируемости тканей. Основными компонентами основного вещества являются гликозаминогликаны (ГАГ) и протеогликаны (которые содержат ГАГ).Гликозаминогликаны
ГАГ представляют собой неразветвленные полисахариды, состоящие из повторяющихся дисахаридных звеньев. Один из сахаров всегда ацетилирован или сульфатирован, а другой почти всегда представляет собой уроновую кислоту (образующуюся из уридиндифосфата (УДФ)-глюкозы в пути уроновой кислоты). Гиалуроновая кислота представляет собой ГАГ, состоящий из повторяющихся единиц дисахарида глюкуроновой кислоты/N-ацетилглюкозамина. Он имеет слизистую консистенцию и обнаруживается в синовиальной жидкости и стекловидном теле глаза.Протеогликаны
Все остальные ГАГ сульфатированы и связаны с коровым белком с образованием протеогликана.Существует множество различных протеогликанов (также называемых мукополисахаридами), выполняющих различные функции:
- Они являются компонентами слизи.
- Они являются основными компонентами аморфного основного вещества.
- Гепарин, протеогликан-антикоагулянт, предотвращает чрезмерное свертывание крови вдоль сосудистой стенки во время воспалительной реакции.
- Они обеспечивают клеточную поверхность гладкой гидрофильной оболочкой — гликокаликсом.
- Аггрекан, большой протеогликан, образует большие агрегаты, придающие хрящам устойчивость и эластичность.
Патология
Мукополисахаридозы
Дефекты деградации протеогликанов вызывают накопление в лизосомах разных стадий деградации. Синдром Гурлера обусловлен дефицитом α-идуронидазы, которая необходима для гидролиза концевых остатков α-идуроновой кислоты из ГАГ. Пациенты нормальны при рождении, но вскоре у них развиваются гепатоспленомегалия, умственная отсталость и грубые черты лица из-за накопления ГАГ в паренхиматозных клетках. Эти пациенты также выделяют непереваренные ГАГ.Ключевые моменты о белках соединительной ткани
Существует по крайней мере 19 типов коллагена, которые различаются по составу α-цепи, при этом типы I, II и III составляют около 70% от общего количества; тропоколлаген представляет собой правозакрученную тройную спираль левозакрученных α-цепей. Синтез проколлагена предотвращает преждевременную сборку коллагеновых фибрилл внутри клетки.Эластин представляет собой соединительную ткань, похожую по составу на коллаген, но обладающую свойствами, позволяющими ему изгибаться и растягиваться, как резина. Разрушение эластина нейтрофилами могло бы привести к эмфиземе, если бы не α1-антитрипсин. Гликозаминогликаны и протеогликаны (которые содержат ГАГ) составляют большую часть аморфного основного вещества, которое участвует в клеточной адгезии, образовании слизи, стекловидном теле глаза и опоре для костей.