Введение
Боли в пояснице и шее и плечах, вызванные дегенерацией межпозвоночных дисков, широко распространены среди людей среднего и пожилого возраста во всем мире. Основным методом лечения дегенерации межпозвонкового диска является оперативное вмешательство, включающее межтеловой спондилодез, замену диска и дискэктомию. Но это довольно радикальные методики и не все пациенты готовы к такому лечению.Дегенеративные процессы межпозвонкового диска представляют собой целый ряд молекулярных, клеточных, структурных и функциональных изменений, основным клиническим проявлением которых является болевой синдром. На этом основании традиционная терапия дегенерации межпозвонкового диска направлена на устранение боли и не учитывает истинных причин развития дегенеративных процессов, не исследует возможности дальнейшего восстановления структуры и биомеханической функции диска. Новый подход к изучению молекулярных и клеточных механизмов дегенерации межпозвонкового диска, рассмотрение патогенеза дегенеративных процессов диска с позиций его развития в онтогенезе позволяют открыть новые звенья патогенеза и предложить новые перспективные методы репаративной восстановительной медицины.
Согласно статистике исследований, 80% людей во всем мире в течение жизни испытывали боль в пояснице DALYs and Collaborators, 2017. Этот вид боли в тяжелых случаях может иррадиировать во все нижние конечности, серьезно влияя на качество жизни и работоспособность людей, а также вызывая огромное медицинское бремя; это заболевание стало глобальной социально-экономической проблемой Mart et al., 2014, а основной причиной этой проблемы является дегенерация межпозвоночных дисков Hoy et al., 2015. Для этого заболевания текущее основное лечение можно разделить на нехирургическое и хирургическое лечение. Среди них к нехирургическим методам лечения в основном относятся медикаментозная и физиотерапия. Преобладает мнение, что причины боли в пояснице, вызванной дегенерацией диска, включают кислую среду, вызванную локальным воспалением, компрессию нервных корешков из-за грыжи студенистого ядра (NP) или коллапса диска, а также эктопические чувствительные нервные волокна и кровеносные сосуды, прорастающие в кольцо и НЧ Bailey et al., 2013; Binch et al., 2015; Lama et al., 2018.
Однако наиболее важной причиной является локальная воспалительная среда, поэтому боль в пояснице может быть эффективно уменьшена на ранней стадии дегенерации межпозвонкового диска с помощью только НПВП, хотя грыжи НП еще нет. Также считается, что физиотерапия эффективна для облегчения боли в пояснице, вызванной дегенерацией диска, и некоторые исследования на животных выявили некоторые задействованные механизмы. Гаури и др. обнаружили, что умеренные физические нагрузки могут стимулировать синтез клеток межпозвонкового диска, но чрезмерные физические нагрузки могут разрушать их и способствовать воспалению Gawri et al., 2014. Гульбранд и др. обнаружили, что циркулирующее сжатие и растяжение межпозвонковых дисков может улучшить жизнеспособность клеток межпозвонкового диска за счет увеличения транспорта питательных веществ, достигая тем самым эффекта физиотерапии Gullbrand et al., 2015.
Хотя некоторые исследования доказали эффективность медикаментозной и физиотерапии, этим нехирургическим методам лечения трудно достичь значительных результатов у некоторых пациентов с тяжелой дегенерацией из-за очевидной воспалительной среды и необратимого старения клеток. В настоящее время для пациентов с тяжелой дегенерацией хирургическое лечение по-прежнему является предпочтительным. Основными хирургическими методами являются малоинвазивная поясничная дискэктомия и открытая поясничная хирургия. Хотя хирургическое вмешательство может облегчить симптомы боли в пояснице, существуют проблемы, связанные с длительным периодом восстановления, высокой стоимостью лечения и возможностью осложнений, таких как дегенерация смежного сегмента и рецидив боли Ghiselli et al., 2004; Eliasberg et al., 2016; Ли и др., 2021 г.. В целом, нынешнее основное лечение направлено на лечение симптомов, но не может эффективно восстановить функцию межпозвонкового диска; поэтому, как восстановить первоначальную биологическую и физическую функцию межпозвонкового диска, находится в центре внимания ученых.
В настоящее время сообщается о нескольких методах стимуляции регенерации диска, включая полную замену диска Takeoka et al., 2020, клеточную терапию Hu et al., 2018; Peredo et al., 2020 и генную терапию Feng et al., 2020, 2015; Фэн и др., 2020. Эти новые методы лечения, предназначенные для полного восстановления или имитации исходной функции диска, демонстрируют большой потенциал для развития. В отличие от большинства обзоров, в этом исследовании сначала рассматривается анатомия межпозвонкового диска и патофизиологический процесс дегенерации межпозвонкового диска, и на основе этого процесса вводятся потребности организма в регенеративных материалах. Затем мы обсудили, как горячие материалы для регенерации NP, AF и концевых пластинок хряща, обнаруженные исследователями в последние годы, работают на удовлетворение этой потребности. В то же время мы также проанализировали разрыв между текущим состоянием исследований и идеальной целью и предложили рассматривать межпозвонковый диск как целостную двигательную единицу для изучения его материалов в будущем, а также кратко представили ход исследований общая стратегия регенерации межпозвонкового диска. В настоящее время в большинстве обзорных публикаций по регенерации межпозвонкового диска основное внимание уделяется одному из студенистых ядер или AF. Для сравнения, это исследование может лучше помочь исследователям всесторонне понять горячие точки материалов и помочь в изучении общей стратегии регенерации межпозвонкового диска.
Структура и функция межпозвонкового диска
Позвоночник является одной из важнейших костных структур в организме человека. Он защищает спинной мозг, поддерживает вес тела, замедляет удары и обеспечивает гибкость движений туловища. Позвоночник состоит из позвоночных костей и межпозвонковых дисков рис. 1. Межпозвонковые диски, соединения между позвоночными костями, связки и окружающие их мышцы составляют самые основные двигательные единицы позвоночника, и межпозвоночные диски играют важнейшую роль в этом процессе. Хотя во многих исследованиях изучалась регенерация межпозвонкового диска, различные его структуры обсуждаются отдельно. Однако, поскольку унифицированное движение любой части общей структуры и функции аномалий, вероятно, вызовет возникновение болей в пояснице, нам необходимо понимать различные части физиологических, анатомических и патофизиологических характеристик, искать различия и общность компонентов. Будет удобно составить идеальный план регенерации всей конструкции.
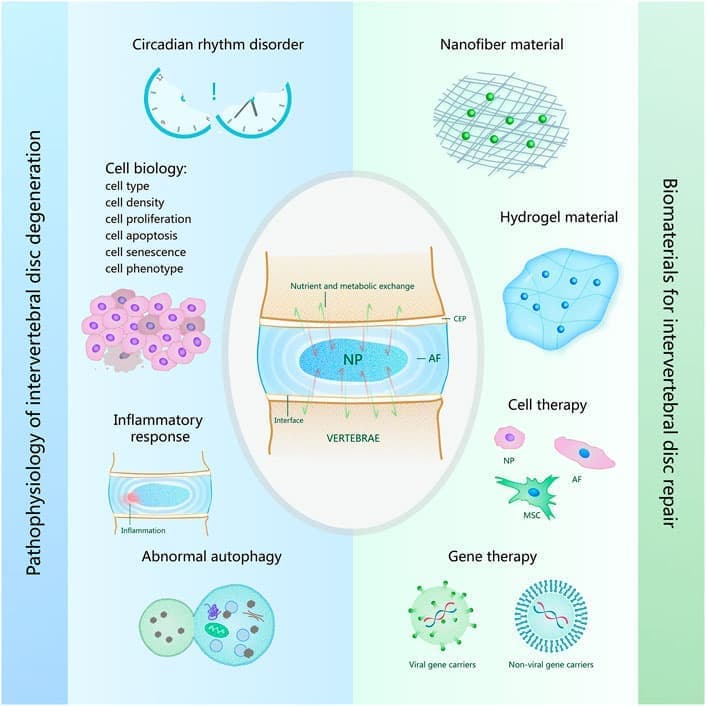
РИСУНОК 1 . Обзор патофизиологии дегенерации межпозвонкового диска и биоматериалов для восстановления межпозвонкового диска. Патофизиологические причины дегенерации межпозвонкового диска, показанные слева на рисунке, включают нарушение циркадного ритма, клеточную биологию, воспалительную реакцию, аномальную аутофагию. Биоматериалы для восстановления межпозвонкового диска, показанные справа на рисунке, включают материал нановолокна, материал гидрогеля, биоматериалы для клеточной терапии и генной терапии.
Диск состоит из студенистой НП, фиброзного кольца, окружающего НП, и хрящевой концевой пластинки рядом с костями верхних и нижних позвонков, которые вместе несут сложную нагрузку, вызванную сжатием, разгибанием, изгибанием и вращением позвоночника Roberts. и др., 2006. Хотя эти структуры взаимодействуют для выполнения одной и той же задачи, их функции, состав и свойства сильно различаются, и даже компоненты внутреннего и наружного фиброзного кольца (AF) различаются.
НП расположен в центре диска; его состав незначительно меняется с возрастом, и в основном он состоит из воды, коллагена типа Ⅱ и эластических белковых волокон, белка, полисахаридов и клеток хорды. По мере старения клетки хорды полностью деградируют и заменяются образцом клеток хряща; одновременно волокна коллагена начинают спариваться; таким образом, НП жидкостью становится хрящевой. Однако вода по-прежнему занимает около 85% объема, что делает его вязкоупругим и устойчивым к деформации при сжатии. NP играет анизотропную однородность при поглощении и рассеивании напряжения и рассеивает давление на AF через деформацию, тем самым облегчая воздействие на нижнюю часть тела позвонка Iatridis et al., 1997. Хондроидные клетки являются метаболически активными клетками при НП и могут синтезировать компоненты внеклеточного матрикса (ECM), такие как коллаген и протеогликан. Он играет роль в поддержании баланса внутренней среды и является основным элементом предотвращения дегенерации межпозвоночных дисков Akkiraju and Nohe, 2015. Волокна эластина и протеогликаны синергируют для поддержания активности коллагена и восстановления размера и формы диска Mouw et al., 2014.
АФ представляет собой бесклеточную и бессосудистую структуру, включающую в основном фиброхондроциты и хондроциты, которые по морфологии сходны с фибробластами. Его компоненты ECM плавно переходят изнутри наружу. Внешний слой состоит в основном из коллагена типа I, а внутренний слой в основном состоит из коллагена типа II Guerin and Elliott, 2007. Коллаген типа II является гипоксическим, гидрофильным и богатым протеогликанами, что согласуется с физическими свойствами твердого внешнего слоя и мягкого внутреннего слоя AF, которые действуют как внешний слой для связывания NP во время изгиба и скручивания. Внутренний слой связывает НЧ при осевом сжатии Eyre and Muir, 1976. С морфологической точки зрения AF состоит из 15–25 концентрических кольцевидных ламелл, представляющих собой в основном аккуратно расположенные пучки коллагеновых волокон. Направление этих коллагеновых волокон составляет 30° к горизонтальной плоскости Humzah and Soames, 1988. Эти слои заполнены межламинарным матриксом, состоящим из эластических волокон, клеток, воды, липидов и протеогликанов. Протеогликаны, включая аггрекан, смазочное масло, ГАГ, бигликан, декорин, перлекан, версикан и т. д., отвечают за смазку и гидратацию. Морфология клеток межламинарного матрикса варьирует от округлой до веретенообразной и от центра к периферии, что связано с направлением и плотностью эластических волокон, а также с направлением и величиной нагрузки на соседние слои. Интерламинарная строма между различными слоями взаимосвязана, соединена разделительными границами и представляет собой плотную эластичную фиброзную структуру, соответствующую роли AF в сопротивлении расширению NP.
Хрящевая замыкательная пластинка представляет собой тонкий гиалиновый слой хряща толщиной примерно 0,6–1,2 мм с наиболее тонкой и пористой центральной областью Zehra et al., 2015; Berg-Johansen et al., 2018. Что касается состава, область, прилегающая к замыкательной пластинке хряща и AF, имеет более высокое содержание коллагена, более низкое содержание протеогликанов и более низкое содержание воды, чем NP Roberts et al., 1989. Хотя AF, NP и замыкательная пластинка хряща анатомически различны, их тонкие структуры пересекаются друг с другом. Коллагеновые волокна в AF вблизи NP переходят в коллагеновые волокна в концевой пластинке хряща, что помогает уменьшить чрезмерную концентрацию напряжения, такого как растяжение, сжатие и сдвиг диска, и предотвратить необратимое повреждение диска Берг-Йохансен и др., 2018 г. Хрящевая замыкательная пластинка также действует как среда для передачи сил в нескольких направлениях между диском и телом позвонка. Хрящевая замыкательная пластинка равномерно распределяет гидростатическое давление, создаваемое НП, на поверхность тела позвонка, чтобы предотвратить локальное расширение НП в тело позвонка. Кроме того, поскольку межпозвонковый диск является самой крупной бессосудистой структурой в организме человека, то кровеносные сосуды в теле позвонка являются его основным источником питания, а капиллярная сеть, образованная аортой, через все ветви образует капиллярную петлю в месте соединения концевая пластинка хряща и межпозвонковый диск Ashinsky et al., 2021. Таким образом, концевая пластинка хряща считается основным путем транспортировки пищи и отходов к телу позвонка рис. 1. По мере старения и дегенерации концевая пластинка хряща претерпевает некоторые изменения состава, что снижает проницаемость и ограничивает транспортировку питательных веществ, что считается одной из причин дегенерации межпозвонкового диска Schroeder et al., 2017.
Патофизиология дегенерации межпозвоночных дисков
Высота и внутреннее осмотическое давление межпозвонковых дисков будут изменяться при нагрузке и в состоянии покоя Menon et al., 2021, что в основном обусловлено дневной и ночной деятельностью и отдыхом человека. Интерстициальная жидкость также течет в ответ на это изменение дифференциального давления, что приводит к обмену питательными веществами и обмену веществ для поддержания гомеостаза межпозвонкового диска van der Veen et al., 2007. Однако нарушение циркадных ритмов может увеличить риск дегенерации диска рис. 1 Dudek et al., 2017. Большинство клеток межпозвонкового диска питаются капиллярами тела позвонка. При ухудшении состояния межпозвонкового диска окклюзия костномозговой полости приводит к потере контакта между капиллярами и замыкательной пластинкой хряща, усиливается кальцификация замыкательной пластинки хряща Benneker et al., 2005; Христова и др., 2011.
Дегенерация межпозвонкового диска может вызывать различные биологические изменения клеток, включая изменения типа клеток, изменения плотности клеток, апоптоз клеток, пролиферацию клеток, старение клеток и изменения фенотипа клеток рис. 1 Zhao et al., 2007. Клетки хорды — это своего рода клетка, существующая на ранней стадии развития человека. По мере роста человека клетки хорды замещаются клетками NP, указывая на то, что начало дегенерации межпозвонкового диска может быть связано с исчезновением клеток хорды McCann et al., 2012. Также было показано, что индукция плюрипотентных стволовых клеток в клетки хорды путем инъекции снижает дегенерацию межпозвонкового диска на моделях свиней Sheyn et al., 2019. Плотность клеток NP в дегенерированных дисках уменьшилась по сравнению с нормальной тканью диска Liu C. et al., 2020. Поскольку чрезмерная механическая нагрузка может вызвать апоптоз стволовых клеток, происходящих из NP, некоторые люди пытаются отсрочить дегенерацию межпозвонкового диска с помощью антиапоптоза He et al., 2021, и было также доказано, что стимулирование пролиферации клеток NP ингибирует дегенерацию межпозвоночного диска Куи и др., 2020 г. В последние годы, по мере углубления исследований, постепенно стали рассматривать фенотипические характеристики клеток НП и взаимосвязь между клеточным старением и дегенерацией межпозвонкового диска Choi et al., 2015; Zhang Y. et al., 2020.
По мере старения возникновение дегенерации межпозвонкового диска становится все более и более вероятным Cheung et al., 2009, и наиболее распространенным клинически связанным симптомом является боль в пояснице. Согласно существующим исследованиям, причиной боли, скорее всего, является воспаление рис. 1 Lyu et al., 2021. Тессье и др. обнаружили значительные изменения провоспалительного пути и возрастную дегенерацию диска у мыши с дефицитом белка, связанного с развитием эмбрионального диска Tessier et al., 2020. Чен и др. обнаружили, что мелатонин может задерживать прогрессирование дегенерации диска и облегчать связанную с ним боль в пояснице, изучая его противовоспалительный эффект in vivo Chen et al., 2020.
Недавние исследования показали, что дегенерация межпозвонкового диска также связана с ингибированием аутофагии рис. 1 Lan et al., 2021. Аутофагия играет роль в поддержании гомеостаза внутренней среды Mizushima, 2007. Он может удовлетворять метаболические потребности за счет лизосомной деградации и восстановления клеточных продуктов, а также защищать клетки, удаляя поврежденные органеллы и неправильно свернутые белки. Аутофагия также связана с другими факторами, которые могут влиять на дегенерацию межпозвонкового диска. Циркадные ритмы могут поддерживать соответствующую аутофагию для предотвращения дегенерации диска, в то время как аномальные циркадные ритмы могут вызывать чрезмерную аутофагию и дисфункцию аутофагии, вызывающую дегенерацию диска Zhang T.-W. et al., 2020. Чен и др. обнаружили, что запуск аутофагии также может уменьшить старение клеток и апоптоз, что в конечном итоге улучшит дегенерацию межпозвонкового диска Chen et al., 2018. В последующих исследованиях многие люди уменьшили старение клеток и апоптоз за счет активизации аутофагии, тем самым поддерживая восстановление межпозвонкового диска и задерживая дегенерацию He et al., 2021; Hu et al., 2021.
Биоматериалы для восстановления пульпозного ядра
Нановолоконный материал
Функция диска зависит от гибкости NP и прочности AF. Нановолоконный материал представляет собой новый вид биологического материала, получаемого методами растяжения, темплатного синтеза, самосборки, микрофазового разделения, электростатического формования и другими методами на основе различных искусственных полимеров. Среди них метод электропрядения широко используется при получении медицинских материалов благодаря его преимуществам, заключающимся в простоте эксплуатации, широком диапазоне применения и относительно высокой эффективности производства. Из-за своей легко регулируемой формы и структуры он часто имеет отличные механические свойства. Поэтому способы повышения биологической стабильности таких материалов находятся в центре внимания исследователей. Серия полиуретановых (PU) биоматериалов может регулировать эластичность за счет изменения состава мономерных звеньев и размера блоков различных мономеров в полимерной цепи. Среди них поликарбонат (ПК) ПУ проявляет лучшую биологическую стабильность и может быть использован в качестве хорошего материала для замены НП и восстановления межпозвонкового диска. Двухфазный полиуретановый стент, состоящий из материала сердцевины с быстрым набуханием и гибкой электроспиннинговой оболочки, был изготовлен и имплантирован в межпозвонковые диски крупного рогатого скота, восстанавливая механические свойства вылущенных дисков и демонстрируя потенциал для замедления дальнейшей дегенерации естественной ткани диска Ли и др., 2016. Поскольку на поведение клеток влияют характеристики ВКМ, биоматериалы, имитирующие характеристики ВКМ, обычно полезны для роста клеток Nesti et al., 2008; Kaur and Roy, 2021, а каркасы из нановолокон обладают уникальными физическими характеристиками, которые обеспечивают благоприятные сигналы клеточного матрикса для роста клеток. усиливают активность клеток рис. 1 Li et al., 2006. Чжан и др. разработали новый тип губчатых микросфер из нано волокна (NF-SMS) со структурой взаимосвязанных пор, которая имитирует белковое волокно ECM Zhang et al., 2015, и было доказано, что он способствует адгезии, пролиферации и np-подобной дифференцировке мезенхимальных стволовых клеток, а взаимосвязанные поры могут эффективно вмещать клетки, способствовать передаче медиатора и формированию нового ECM Feng et al., 2020.
Гидрогелевый материал
Гидрогели могут быть получены физическим сшиванием (за счет гидрофобного взаимодействия, водородных связей, электростатической силы и т. д.) или химическим сшиванием (через ковалентное связывание). По источнику гидрогели можно разделить на три категории: природные, синтетические и композитные гидрогели. Среди них природные материалы включают фибрин, альгинат, хитозан и т. д., которые обладают большими преимуществами в плане биосовместимости и низкой цитотоксичности и, таким образом, широко используются для регенерации и восстановления студенистого ядра Рисунок 1. Однако несоответствие его механических свойств приводит к выходу имплантата из строя на поздней стадии дегенерации диска из-за структурных повреждений, вызванных длительной компрессией. Поэтому, как улучшить механические свойства гидрогелей находится в центре внимания исследователей. Ган и др. разработали армированный и упрочненный гидрогель взаимопроникающей сети (IPN) для регенерации NP, который имеет такие преимущества, как механические свойства, подобные NP, и высокую ударную вязкость. Инкапсуляция клеток NP в гидрогель четко показала усиленную пролиферацию клеток, естественный фенотип образования хряща и секрецию ECM. Исследования in vivo также подтвердили, что гидрогели IPN могут поддерживать удержание и выживание клеток в течение длительного времени, тем самым способствуя регидратации и регенерации деградировавших NP Gan et al., 2017.
Хотя жесткость и ударная вязкость гидрогелей с двойной сеткой были значительно улучшены, длительное время подготовки или непрерывная подготовка затрудняли отверждение на месте . Использование композитного гидрогеля является альтернативным методом, который имеет более высокую жесткость и прочность, но также сохраняет характеристики одноэтапного приготовления гидрогеля, сокращает время отверждения и подходит для введения in situ . Шмокер и др. разработали композиционный гидрогель с функциональными свойствами, подобными свойствам природного бычьего НЧ. Высота диска восстановилась с 65,6 до 99,0% в условиях in vitro .исследования и остались прежними после 500 000 циклов нагрузки. Через пятнадцать дней после имплантации гистологически наблюдали непрерывную ненарушенную поверхность раздела ткань/имплантат. Такой композитный гидрогель с превосходными механическими свойствами имеет большой потенциал для клинического применения Schmocker et al., 2016.
Дегенерация сердцевины ядра характеризуется потерей гидратации и склерозом тканей. Гистологически можно наблюдать снижение плотности клеток, потерю сульфатированных гликозаминогликанов (сГАГ) и коллагена II типа, а также увеличение коллагена I типа. В ответ на это Chiara Borrelli et al. предположили, что производство sGAG можно увеличить , добавив в гидрогель хондроитинсульфат, и обнаружили, что его присутствие имеет решающее значение для синтеза коллагена типа II. фибробластоподобное состояние Chen et al., 2009; Risbud et al., 2015. Предыдущие исследования показали, что мягкий полиэтиленгликолевый (ПЭГ) субстрат, функционализированный ламинином 111, может повторно экспрессировать ювенильный фенотип дегенеративных ядерных пульпоцитов, предполагая, что мягкий субстрат играет роль в фенотипическом восстановлении дегенеративных ядерных пульпоцитов Gilchrist et al., 2011; Francisco и др., 2014; Fearing и др., 2019. Однако при изучении стволовых клеток, полученных из NP (NP-SC), Navaro et al. обнаружили, что пролиферация и дифференцировка клеток не зависят от твердости матрикса при изучении NP-SC, но подчеркнули влияние модуля матрикса на судьбу NP-SC Navaro et al., 2015. В недавнем исследовании Barcellona et al. подтвердил этот момент. Мы разработали гидрогелевый каркас, функционализированный дипептидами, с регулируемыми механическими свойствами и презентацией адгезивного лиганда для контроля морфологии и фенотипа клеток NP. В экспериментах было продемонстрировано, что строгий контроль отбора пептидов и презентации пептидов индуцирует более молодые фенотипы клеток NP независимо от твердости субстрата, поэтому может быть, что презентация лиганда адгезии действительно влияет на фенотипы ядерных пульпоцитов Barcellona et al., 2020.
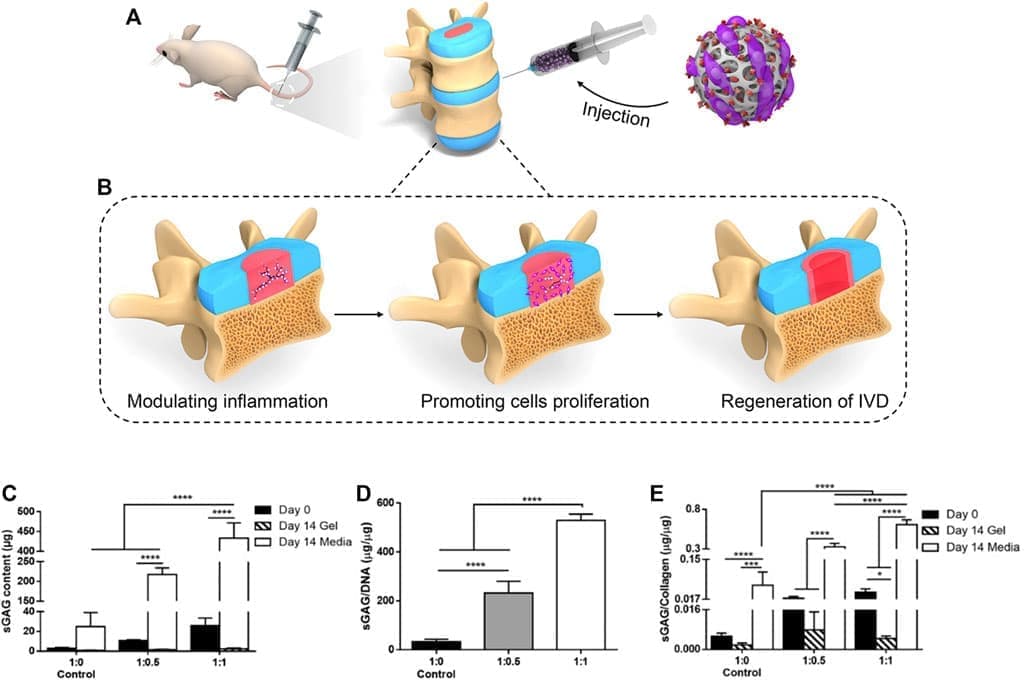
РИСУНОК 2. (A) Инъекция гидрогелей в крысиной модели дегенерации МПД
(A) Адаптировано из Borrelli and Buckley 2020
(B) Функция, обеспечиваемая гидрогелем в регенерации дегенерации МПД, включая модулирование локального воспаления, продвижение студенистого ядра пролиферация клеток и регенерация межпозвонкового диска (МПД)
(C,D) Было обнаружено, что синтез sGAG зависит от исходного состава геля, при этом значительно больше sGAG откладывается клетками в гелях, содержащих более высокое исходное sGAG
(E) Было обнаружено, что отношение sGAG/коллаген линейно увеличивается с увеличением количества CS, присутствующего в исходной композиции геля
(Б – Д) Адаптировано из Bian et al. 2021.
Потеря питательных веществ из стента ограничивает его эффективность в стимулировании регенерации диска. Исследования показали, что клеткам NP необходим кислород и другие питательные вещества для синтеза молекул матрикса, и различные концентрации кислорода также влияют на соотношение состава ECM Mwale et al., 2011. Сан и др. использовали перфтортрибутиламин (PFTBA) для регулирования кислорода, не влияя на альгинат. Выживаемость и пролиферация клеток NP человека, культивируемых в альгинатных каркасах, богатых PFTBA, повышались, а ECM модулировался в ткани межпозвонкового диска. Высота диска и внеклеточный матрикс были восстановлены в мышиной модели дегенерации межпозвонкового диска, что показало положительное влияние на облегчение дегенерации межпозвонкового диска Sun et al., 2016.
Биоматериалы для доставки генов
После дегенерации НП фенотипические изменения клеток НП приводили к дисбалансу анаболизма и катаболизма ВКМ. Современные методы лечения, такие как симптоматическое лечение или хирургическое лечение, могут облегчить симптомы в краткосрочной перспективе, но не могут решить основную проблему. Генетическая модификация клеток межпозвонкового диска путем контролируемой и специфической доставки генетического материала (ДНК или РНК) является многообещающим терапевтическим подходом рис. 2 Roh et al., 2021. Многие исследователи успешно перенесли гены в ткани межпозвонкового диска с помощью вирусных систем доставки генов рис. 2 Leckie et al., 2012; Han et al., 2021, но очевидные побочные эффекты ограничивают дальнейшее клиническое применение. Проблемой ретровирусных векторов является риск инсерционной мутации, тогда как проблемой аденовирусных векторов является иммуногенность трансдуцированных клеток Tripathy et al., 1996; Wallach et al., 2006, и несколько пациентов даже умерли после введения вирусного вектора . в клинических испытаниях Evans et al., 2008. С точки зрения безопасности невирусные векторы и полимицеллы являются лучшим выбором для генной терапии межпозвоночных дисков рис. 2.
Чжан и др. разработали новый тип носителя из гиперразветвленного полимера (HP) для доставки анти-миР-199a (AMO) в сочетании с биоразлагаемыми наносферами (NS) поли(молочная кислота-со-гликолевая кислота) (PLGA) для устойчивого высвобождения AMO и путем блокирования миР-199a может активировать фактор, индуцируемый гипоксией (HIF)-1α. NF-SMS как каркас, несущий мезенхимальные стволовые клетки (MSC), может, наконец, способствовать дифференцировке MSC NP и ингибировать ее остеогенную дифференцировку, одновременно усиливая регенерацию ткани NP Feng et al., 2020. Фэн и др. также синтезировали смешанную составную мицеллу (MPM) для доставки терапевтической плазмидной ДНК (pDNA), что было подтверждено in vitro и in vivo .оценки для повышения эффективности трансфекции клеток NP. После связывания с гемоксигеназой-1 (HO-1) пДНК он может ослаблять воспалительную реакцию и увеличивать продукцию NP ECM, тем самым замедляя дегенерацию межпозвонкового диска Feng et al., 2015.
Биоматериалы для восстановления фиброзного кольца
В процессе поясничной боли, обусловленной дегенерацией межпозвонкового диска, безусловно, ведущую роль играет дегенерация НП, но неполная структура ФП также является одной из причин возникновения и рецидивов поясничной боли. Согласно исследованиям, в большинстве случаев дегенерация межпозвонкового диска сопровождается повреждением AF, в основном после грыжи НП Tavakoli et al., 2020. В настоящее время многие из лечебных эффектов, которые в настоящее время нацелены только на регенерацию NP, будут значительно снижены, например, клеточная терапия и терапия биоактивными факторами. Большинство этих методов лечения доставляют лекарства путем местной инъекции. После повреждения AF это приведет к утечке впрыснутого материала, из-за чего впрыснутый материал не сможет оставаться на месте в течение длительного времени и не сможет оказывать свой первоначальный эффект. Конструктивная целостность АФ является основой сохранения гидростатического давления НП. Таким образом, даже если НП полностью регенерируется с неустраненной ФП, это вызовет повторное выпячивание НП под действием аксиального давления.
Поэтому ученые давно признали важность регенерации ФП. Сначала ученые использовали индивидуальные и персонализированные швы для сшивания переломов AF или использовали полимерные сетки и закрепляли их на соседних костях позвонков Bailey et al., 2013; Vukas et al., 2015; Bowles and Setton, 2017. Однако эти два типа не получили широкого применения из-за длительного времени операции и высокой стоимости операции, и некоторые исследования считают, что это лечение может только уменьшить боль и скорость повторного вклинения НП на определенный период, но не может восстановить исходную структуру и функцию AF и ускорить риск дегенерации межпозвонкового диска Trummer et al., 2013; Choy et al., 2018.
Гидрогелевый материал
Стремясь к идее местного восстановления, биологический пластырь, наложенный на ФП, был тщательно изучен. В настоящее время доказано, что некоторые природные полимеры или синтетические биологические материалы эффективно восстанавливают поврежденную структуру АЖ и предотвращают повторное гемиализирование НЧ. Например, гидрогель, природный полимер, можно использовать для регенерации как NP, так и AF. Пэн и др. разработали инъекционный гидрогель бесклеточного АФ, сшитый генипином (g-DAF-G), и доказали, что он обладает лучшей биосовместимостью, биологической активностью и более высокой механической прочностью, чем несшитый гидрогель бесклеточного АФ, обеспечивая простую и быструю альтернативу лечению для восстановления Повреждение или разрыв ФП рис. 3 Peng et al., 2020a. Другое исследование показало, что, регулируя концентрацию сшитого генипина и изменяя условия сшивания, можно контролировать его физические и химические свойства, чтобы они соответствовали различным требованиям для восстановления тканей AF и NP Wang et al., 2020. Также было проведено исследование оптимального времени введения гидрогеля Liu Z. et al., 2020.
В исследовании были выбраны макаки-резусы для построения модели дегенерации межпозвонкового диска, с использованием МРТ для оценки степени дегенерации и доказано, что умеренная дегенеративная стадия (значение T1ρ от 95 до 80 мс) может быть лучшим временем для инъекции гидрогеля для регенеративного вмешательства. Гель фибрина также считается одним из наиболее часто используемых природных полимеров в регенерации ФП. Поскольку ткань АЖ богата коллагеном, она имеет более низкий ответ иммунного отторжения. Круз и др. изучали механические свойства гелей поперечно-сшитого генипина фибрина, образованных при различных концентрациях генипина Cruz et al., 2017. Результаты показали, что по мере увеличения концентрации генипина прочность на сжатие и модуль сдвига геля увеличивались, превосходя естественную ткань AF. Однако улучшение механических свойств фибринового геля будет иметь определенные побочные эффекты, приводящие к снижению выживаемости местных клеток, поскольку гель слишком твердый и будет препятствовать поступлению питательных веществ. Исследования показали, что 6% генипин может поддерживать хорошую выживаемость клеток и достигать достаточной механической прочности. Другое исследование показало, что коллагеновый гель высокой плотности (HDC), сшитый рибофлавином, также может быть использован для восстановления ФП Moriguchi et al., 2018.
В исследовании сравнивали индекс высоты диска (DHI), размер и гидратацию NP в группе, не получавшей лечения, в группе с перекрестно сшитыми HDC и в группе с перекрестно сшитыми HDC, которым вводили клетки AF через 5 недель, и было обнаружено, что средний DHI двух групп с гелем HDC превышал средний показатель контрольной группы через 5 недель. По сравнению с бесклеточным гелем HDC, гель HDC, загруженный клетками AF, ускорял восстановление в роли уплотнения. Было доказано, что гель HDC, содержащий клетки AF, обладает лучшей способностью восстанавливать кольцевые дефекты после иглоукалывания, чем гель без клеток. Борем и др. доказали, что добавление Интерламеллярного матрикса (ILM) GAG также может эффективно улучшить способность пластыря противостоять ударным нагрузкам и предотвратить грыжу естественных тканей МПД при приложении сверхфизиологической нагрузки (5,28 ± 1,24 МПа), Борем и др., 2019. Кроме того, многие биосинтетические материалы также обладают определенными преимуществами в восстановлении AF, например, D, L-акрилоиловый эфир и триметилкарбонат могут иметь функцию морфологической памяти, поли (триметиленкарбонат) (PTMC) в сочетании с эластичной полиуретановой пленкой может предотвратить выпячивание бычьего NP. снова в течение 14 дней при динамической нагрузке, и триолмалат PCL может разлагаться, так что можно регулировать механические свойства волокнистого кольца Pirvu et al., 2015.
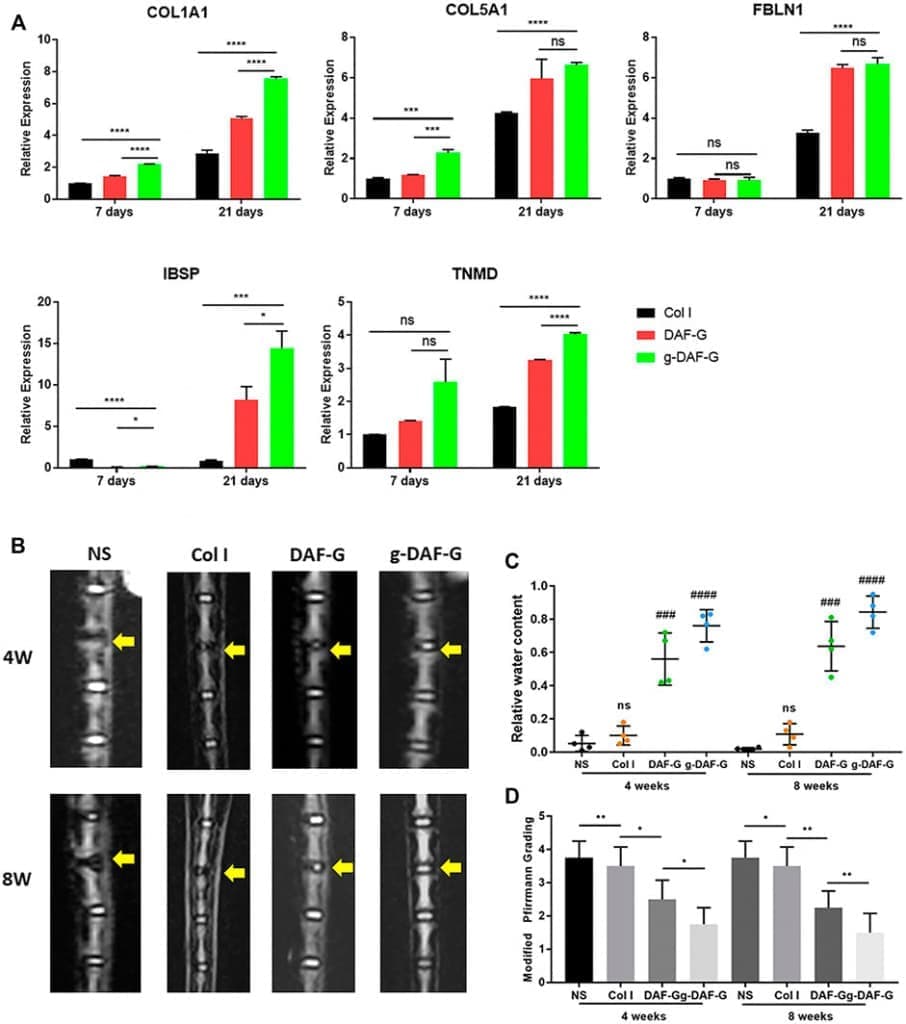
РИСУНОК 3. (А) Уровень экспрессии генов, специфичных для ФП (коллаген-1А1(COL1A1), коллаген-5А1 (COL5A1), фибулин-1 (FBLN1), интегрин-связывающий сиалопротеин (IBSP) и теномодулин (TNMD)) был значительно выше. выше в группах DAF-G и g-DAF-G, чем в группе Col I на 21-й день, что указывает на потенциальную индукцию направленной специфической дифференцировки hBMSCs в направлении клеток AF на гидрогелях DAF-G и g-DAF-G. (B) Т2-взвешенные изображения показали, что межпозвонковое пространство стало уже, а интенсивность сигнала области NP резко снизилась в группе с нормальным физиологическим раствором (NS) по сравнению с соседними и интактными дисками. (С)Количественный анализ показал, что относительное содержание воды в группах DAF-G и g-DAF-G было больше, чем в группах с гелем Col I и NS, что указывает на потенциальную регенеративную функцию гидрогелей, полученных из AF, на дефект ткани AF. (C, D) Восстановительный эффект, проанализированный количественным анализом и модифицированной оценкой Pfirrmann, был лучше в группе g-DAF-G, чем в группе DAF-G, показывая, что механическая прочность, улучшенная генипином, может быть жизненно важным фактором в восстановлении ФП (A – D) Адаптировано из Peng et al. 2020a.
В последние годы исследования гидрогелей для восстановления фиброзного кольца становятся все более и более глубокими. Пэн и др. использовали матрикс бесклеточной ткани фиброзного кольца быка для получения гидрогеля, и интегрин-опосредованный сигнальный путь RhoA/LATS/YAP1 может способствовать специфической дифференцировке стволовых клеток в AF для восстановления AF Peng et al., 2021. Кроме того, Лю и соавт. использовали бионическую структуру для приготовления анизотропного гидрогеля древесной целлюлозы, который в основном отвечает за буферизацию напряжения и поглощение энергии (рассеивание энергии не менее ∼60%), как и ткань AF Liu et al., 2021. Однако из-за плохой адгезии или низкой прочности на разрыв между гидрогелями и поверхностью влажной ткани DiStefano et al. разработали дважды модифицированный гликозаминогликан для ковалентного связывания гидрогелей с тканью ФП, тем самым оптимизировав метод герметизации дефекта ФП DiStefano et al., 2020.
Нановолоконный материал
Некоторые исследования считают, что как биологические пластыри, так и технология наложения швов только усиливают ФП, но не лечат воспаление, возникающее при ФП Wang et al., 2021. В этом исследовании композитная пленка PLGA/поликапролактон (PCL) Zdextran (DEX), наполненная экстрактом тестикулярных пластид (PTE), была приготовлена путем электропрядения в лабораторных условиях .модель воспаления. Цитосовместимость и противовоспалительный эффект материала были проверены, и мы обнаружили, что композитные нановолоконные мембраны P10P8D2 (PLGA 10 г, PCL 8 г, DEX 2 г) демонстрируют наиболее равномерное распределение диаметра, лучшие механические свойства, умеренную скорость деградации и наилучшие характеристики совместимости ячеек. Он может одновременно оказывать противовоспалительное действие и стимулировать пролиферацию клеток. Другие исследования показали, что фиброзные каркасы из поли(эфиркарбоната карбамида) мочевины (PECUU) могут регулировать дифференцировку стволовых клеток, полученных из амниотической жидкости (AFSC), прикрепленных к каркасам, регулируя изменения размера волокон и эластичности каркасов Zhu et al., 2016 г., Чу и др., 2021 г.
На скаффолде с большими волокнами и сильной эластичностью экспрессия фенотипических маркерных генов во внешнем кольце усиливается; на скаффолде с мелкими волокнами и низкой эластичностью экспрессия фенотипических маркерных генов во внутреннем кольце усилена. Было доказано, что это контролируется активацией оси механической трансдукции CAV1-YAP. Другое исследование пришло к такому же выводу. Они доказали, что белки, родственные YAP, играют ключевую роль во влиянии на направление дифференцировки AFSCs Chu et al., 2019. Лю и др. также способствовали направленной дифференциации АКСД рис. 4 Liu et al., 2015. Они доказали, что, по сравнению со случайными стентами, каркасы из полиуретана с выровненными волокнами могут сделать AFSC удлиненными и лучше выровненными, а также увеличить экспрессию коллагена I и протеогликанового матрикса, обеспечивая благоприятное микроокружение для клеток внешнего слоя клеток AF. Таким образом, такой каркас может эффективно индуцировать изменения формы клеток, адгезии и экспрессии ECM, регулируя размер волокон таким образом, чтобы сконструированная ткань AF имела иерархическую структуру, близкую к структуре природной ткани AF Zhou et al., 2021.
Чен Лю и др. дальнейшее усовершенствование каркаса из нановолокна PECUU Liu Y. et al., 2020. Они обнаружили, что PECUU совместим с механическими свойствами природного ВКМ AF, но не обладает биологической активностью природного ВКМ. Децеллюляризированный матрикс AF (DAFM) обладает хорошей биосовместимостью и биоразлагаемостью, и было доказано, что он способствует секреции ECM, связанного с AF. Он использует технологию коаксиального электропрядения для производства гибридной стойки для электропрядения DAFM/PECUU. Также было доказано, что экспрессия генов и секреция внеклеточного матрикса коллагенов I и II типа и протеогликанов стволовых клеток, полученных из кольца, культивируемых на электропряденом каркасе DAFM/PECUU, превышают таковые для каркаса волокна PECUU. В другом исследовании с помощью технологии 3D-печати был изготовлен каркас нового типа из PCL Christiani et al., 2019. Этот новый тип каркаса также может эффективно имитировать структуру и биомеханические свойства натуральных тканей. Фибробласты кольца могут прикрепляться и диффундировать по нему, а коллаген I типа, аггрекан и апоневротический белок, специфичный для ФП, могут эффективно экспрессироваться. Система прокатки листов ячеек (CSRS) также использовалась в производстве AF. Shamsah et al., 2019 использовали технологию CSRS для изготовления каркаса из электроформованного волокна, состоящего из синтетической биополимерной смеси PCL и поли (L-молочной кислоты) кислоты (PLLA), которая реализует анатомическую структуру AF с полной трехмерной круговой структурой для впервые и доказали, что клетки бычьего кольца могут поддерживать на нем жизнеспособность Shamsah et al., 2019.
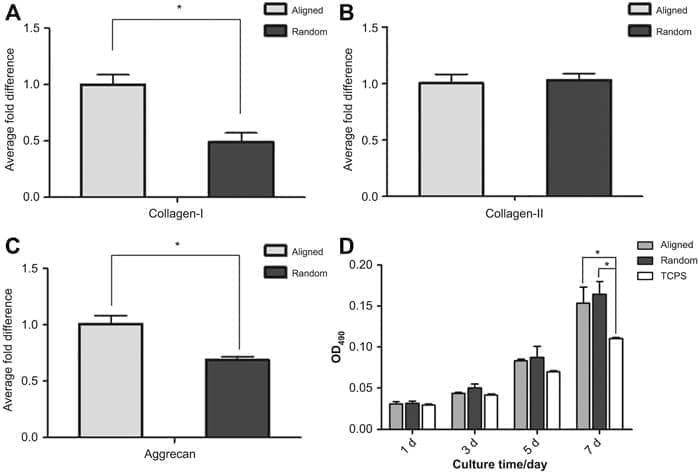
РИСУНОК 4. (A) Количественная ПЦР в реальном времени была проведена для сравнения экспрессии генов коллагена-I, коллагена-II и аггрекана в AFSC, культивируемых на выровненных и случайных каркасах. Через 7 дней культивирования уровень экспрессии коллагена-I в AFSC, культивируемых на выровненных каркасах, был почти в два раза выше, чем у клеток, выращенных на случайных каркасах. (B) Экспрессия коллагена-II была одинаковой как в AFSC, культивируемых на выровненных, так и случайных каркасах. (C) Характер экспрессии аггрекана был аналогичен таковому у коллагена-I; клетки, культивированные на выровненных каркасах, имели примерно в 0,4 раза более высокую экспрессию гена аггрекана, чем клетки, выращенные на случайных каркасах. (Д)Не было очевидной разницы в пролиферации клеток между AFSC, культивируемыми на выровненных каркасах, и на случайных каркасах. (A – D) Адаптировано из Liu et al. 2015.
Биоматериалы для клеточной терапии
Основным преимуществом биоматериалов является то, что их можно использовать для доставки клеток. Клеточная терапия является многообещающей терапией, которую можно разделить на эндогенную и экзогенную клеточную терапию рис. 1. Эндогенная клеточная терапия относится к локальному введению клеток для производства биологически активных факторов или прямому введению биологически активных факторов для стимуляции регенерации клеток in situ , в то время как экзогенная клеточная терапия восстанавливает ФП путем прямой инъекции фибробластов кольца или стволовых клеток, которые можно индуцировать для дифференцировки в кольцо. фибробласты. Поскольку ФП является структурой с дефицитом клеток, в сочетании с локальным воспалением, вызванным дегенерацией межпозвонкового диска, количество клеток ФП in situдополнительно снижается. При стимуляции биологически активными факторами недостаточно пролиферировать и дифференцироваться, чтобы компенсировать локальное воспаление ФП. Это самая серьезная проблема эндогенной клеточной терапии. Наиболее важным ограничением экзогенной клеточной терапии является плохое удержание клеток в месте инъекции. Это вызвано потерей якоря, называемой anoikis, которая может вызвать гибель клеток Discher et al., 2009.
Терапия мезенхимальными стволовыми клетками в настоящее время является наиболее изученным видом экзогенной клеточной терапии Sakai and Andersson, 2015. В некоторых исследованиях сообщается, что инъекция мезенхимальных стволовых клеток усугубляет степень дегенерации межпозвонкового диска Vadala et al., 2012. Это связано с тем, что клетки, введенные в этом исследовании, протекли. В большинстве исследований, которые не были раскрыты, мезенхимальные стволовые клетки костного мозга (СКМСК) могут эффективно дифференцироваться в клетки межпозвонкового диска, способствовать синтезу ВКМ межпозвонкового диска Chiang et al., 2019 и улучшать клинический исход у пациентов с межпозвонковым диском . дегенерация Sun et al., 2019. Поэтому многие ученые признали идею о том, что мезенхимальные стволовые клетки могут регенерировать межпозвонковые диски. В настоящее время многие исследователи сосредоточились на том, как улучшить метод доставки клеток, как вызвать направленную дифференцировку мезенхимальных стволовых клеток и как доставленные клетки могут сохранять свою биологическую активность в течение более длительного времени Tibiletti et al., 2014.
После многих лет исследований исследователи обнаружили, что биоматериалы являются эффективными носителями для клеточной терапии от Американской ассоциации нейрохирургов и др., 2018. Все больше технических материалов, включая природные полимеры, синтетические полимеры и их комбинации, применяются для восстановления межпозвонковых дисков Peng et al., 2020b. Это связано с тем, что биологические материалы могут изолировать эти клетки, используемые для регенерации межпозвонкового диска, от воспалительной среды или других факторов, вызывающих суровую биологическую среду межпозвонкового диска, и могут удерживать эти клетки в месте инъекции Bertram et al., 2005. Поэтому то, как различные материалы влияют на стволовые клетки, находится в центре внимания текущих исследований. По сравнению с клеточной терапией для регенерации НП, относительно мало исследователей клеточной регенерационной терапии для ФП. Это также связано с высокой сложностью строения АФ и повышенными требованиями к балансу механических и биологических свойств. Буниа и др. создали многослойную дискообразную структуру рогового слоя на основе протеина шелка, состоящую из концентрических ламеллярных слоев, которая имитирует нативную иерархическую структуру AF и может эффективно поддерживать пролиферацию, дифференцировку клеток и отложение ECM, что может способствовать регенерации AF Бхуния и др., 2018 г.
В дополнение к структуре материала биологически активные факторы, добавленные к материалу, также играют важную роль в эффективности клеточной терапии. Бланкер и др. обнаружили, что добавление трансформирующего фактора роста (TGF)-β3 к каркасу AF, сконструированному из PTMC с помощью стереолитографии, может способствовать дифференцировке жировых стволовых клеток человека в AF Blanquer et al., 2017. Инокуляция фибриновым гелем может улучшить распределение и пролиферацию жировых стволовых клеток и производство матрикса, подобного АЖ. Мало того, что выработка сульфатированного sGAG и коллагена значительно повышается, так еще и сформированный коллаген ориентируется и упорядочивается в виде пучков в сконструированных порах. Хотя природные полимеры обычно имеют лучшую биосовместимость и большее сходство с природными микроструктурами и ингредиентами, их механические свойства часто ограничены. Поэтому изучается синтетическая матрица с хорошим составом и контролируемой биоразлагаемостью. Пирву и др. разработали матрикс ПТМК, покрытый ПУ-мембраной и засаженный СККМ человека, который выдерживает динамические нагрузки, восстанавливает разрушенную бычью АФ-ткань на высоту межпозвонкового диска, предотвращает протрузию НП, дифференцируетin situ Пирву и др., 2015.
Хотя экзогенная клеточная терапия достигла хороших результатов в регенерации АЖ, эти клеточные носители, изготовленные из природных полимеров или синтетических полимеров, остаются инородными телами по сравнению с человеческим организмом, что может вызывать в большей или меньшей степени иммунное отторжение. В то же время процесс доставки этих материалов в дегенерированный межпозвонковый диск тела человека является инвазивной операцией, вызывающей вторичное повреждение AF и NP. Таким образом, эндогенная клеточная терапия, основанная на концепции индукции регенерации и пролиферации клеток in situ , должна стать основным направлением усилий будущих исследователей. В настоящее время исследователи обнаружили, что с помощью эффекта самонаведения стволовых клеток можно эффективно преодолеть недостатки эндогенной клеточной терапии.
По материалам Американской ассоциации нейрохирургов и др., 2018 г. Хоуминг СККМ — это процесс рекрутирования клеток из исходной биологической среды в поврежденные или патологические ткани. При стимуляции стволовых клеток определенным биологически активным фактором они мобилизуются в периферический кровоток и мигрируют в поврежденные ткани или органы Fong et al., 2011. Однако текущее понимание точного процесса и механизма того, как СККМ мобилизуются и направляются в положение эффектора, остается неполным. Однако исследователи полагают, что СККМ совместно управляются несколькими сигнальными молекулами клеток, а сама поврежденная ткань экспрессирует уникальные рецепторы или лиганды, способствующие проникновению СККМ в пораженную область Sordi, 2009.
В настоящее время доказано, что существуют различные факторы роста и хемокины, способные индуцировать миграцию мезенхимальных стволовых клеток, такие как фактор некроза опухоли-α, интерлейкин-1β (ИЛ-1β) Ponte et al., 2007, инсулиноподобный фактор роста-1 (IGF-1) и тромбоцитарный фактор роста-AB (PDGF-AB) и т. д., но они оказывают индуцирующее миграционное действие на различные стволовые клетки, и исследователи обнаружили, что хемокины Наибольшее влияние на СККМ оказывает RANTES (также известный как CCL5), хемокин макрофагов (MDC) и фактор 1 стромальных клеток (SDF-1), и все они повышены в дегенеративных тканях диска Pattappa et al. др., 2014 г. Однако разочаровывает тот факт, что исследования Tam et al. и Кунья и др. обнаружили, что способность стволовых клеток попадать в организм посредством внутривенной инъекции относительно ограничена Tam et al., 2014; Cunha et al., 2017. Это может быть связано с отсутствием кровеносных сосудов в межпозвонковом диске, но в дегенерированных межпозвонковых дисках человека врастает много новых кровеносных сосудов, что не может быть смоделировано экспериментами на животных, и эти новые кровеносные сосуды потенциально могут способствовать СККМ, достигая поврежденного участка и способствуя регенерации.
Биоматериалы для восстановления замыкательной пластинки хряща
Торцевая пластинка является основным путем входа и выхода метаболитов из межпозвонкового диска Malandrino et al., 2014, а недостаточное снабжение необходимыми питательными веществами и накопление отходов часто считаются важными факторами, вызывающими дегенерацию межпозвонкового диска рис. 5 Asinsky et al., 2020. Обызвествление хряща замыкательной пластинки и окклюзия питательных каналов увеличиваются с возрастом Bernick and Cailliet, 1982. Если замыкательная пластинка затвердевает или утолщается, биоматериалы, имплантированные для восстановления диска, могут не дать желаемого эффекта. Поэтому биоматериалов, восстанавливающих структуру и функцию диска, может быть недостаточно, и требуется рассмотрение проходимости замыкательной пластинки. В более ранних исследованиях материалы для ремонта дисков обычно были сосредоточены только на сохранении структурных и механических свойств концевой пластины. Исигуро и др. разработали тканевую инженерную конструкцию без каркаса (TEC), трехмерную матрицу, содержащую недифференцированные MSC высокой плотности. Высота межпозвонкового диска, замыкательная пластинка и ФП сохранялись через 6 месяцев после имплантации в крысиной модели дегенерации диска, а возрастные биомеханические нарушения уменьшались Ishiguro et al., 2019.
По мере развития исследований важность интеграции интерфейса с концевыми пластинками хряща во время восстановления диска получила большое внимание. Hamilton et al. in vitro сформировали трехфазную конструкцию, включающую NP, CEP и матрицу из полифосфата кальция (CPP) (в качестве заменителя кости). Через 8 недель культивирования образовался непрерывный слой ткани NP, который слился с нижележащей хрящевой тканью, которая, в свою очередь, была интегрирована с пористой CPP для улучшения свойств поверхности замещения кости и ткани МПД Hamilton et al., 2006. В недавнем исследовании Chong et al. попытались построить модель интерфейса AF-хрящ in vitro, используя контактную совместную культуру из наружных клеток AF, инокулированных ангулярным слоем, многослойным каркасом PC PU и суставными хондральными клетками. Через несколько недель ткань OAF интегрировалась с хрящом и стала естественным интерфейсом. Кажущаяся прочность на растяжение интерфейса in vitro также была значительно увеличена, и ожидается, что будет достигнута полная клиническая замена диска за счет добавления восстановления концевой пластинки хряща Chong et al., 2020. В настоящее время среди материалов для восстановления межпозвонковых дисков проведено мало исследований по восстановлению и регенерации замыкательных пластин хряща, но все больше и больше исследователей обнаруживают важность замыкательных пластин хряща в восстановлении межпозвонкового диска. Считается, что в будущем будет больше исследований по восстановлению замыкательной пластинки хряща.
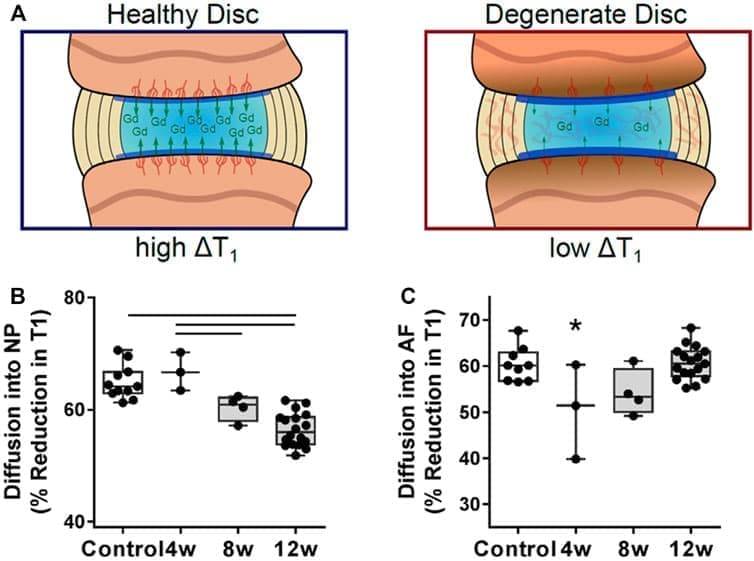
РИСУНОК 5. (A) Изменение времени релаксации T1 в межпозвонковом диске после введения контрастного вещества гадодиамида (B) Внутри NP диффузия гадодиамида в диск прогрессивно уменьшалась и была значительно ниже через 12 недель по сравнению со здоровым контролем. (C) Диффузия в ФП была значительно снижена через 4 недели после пункции, после чего уровень вернулся к контрольным. (A – C) Адаптировано из Ashinsky et al. 2020.
Биоматериалы для восстановления межпозвоночных дисков с использованием комбинированных стратегий
Дегенерация межпозвонкового диска представляет собой процесс, при котором концевая пластинка хряща, NP, AF или биологическое окружение сопровождаются патофизиологическими изменениями. Верхние и нижние фасеточные суставы и окружающие мышцы могут даже подвергнуться дегенерации. Таким образом, исследование регенерации межпозвоночных дисков должно не только рассматривать восстановление одного из них, но и обширное восстановление, чтобы полностью устранить симптом боли в пояснице. Упомянутые выше методы клеточной терапии и тканевой инженерии в различных исследованиях обсуждали воздействие только на одну структуру, но на самом деле их воздействие на межпозвонковый диск является всесторонним, просто влияние на другие структуры не затрагивается. значимой или не имеет клинического значения в настоящее время. Следовательно,
Устранение воспалительной среды и восстановление исходного состояния ВКМ считаются эффективными методами комплексного улучшения состояния межпозвонкового диска Hofmann et al., 2018. Для достижения этой цели дегенерированный межпозвонковый диск должен быть переведен в физиологическое состояние. Потенциальные стратегии включают элиминацию провоспалительных цитокинов и протеаз в ЕСМ; изменение экспрессии генов провоспалительных цитокинов и протеаз в резидентных клетках межпозвонкового диска; и стимулирование резидентных клеток межпозвонкового диска для производства нового ECM. Основываясь на этой стратегии, Гуо обнаружил, что различные факторы роста могут регулировать синтез внеклеточного матрикса, в том числе ингибировать воспаление и подавлять ферменты деградации Guo et al., 2021. Однако факторы роста, включая TGF-β, фактор роста фибробластов (FGF) и IGF-1, могут вызывать нежелательный рост кровеносных сосудов, тем самым ускоряя процесс дегенерации межпозвоночных дисков. Только GDF-5 может эффективно смягчить дегенерацию межпозвонкового диска, не вызывая врастания кровеносных сосудов. Сабери и др. обнаружили, что митохондриальная дисфункция также является одним из факторов дегенерации межпозвоночных дисков Saberi et al., 2021.
Это связано с тем, что митохондрии являются основным источником клеточного энергообеспечения и основным источником активных форм кислорода, что является основной причиной воспалительной среды межпозвонкового диска. Во-первых, доказано, что MitoQ, MitoTEMPO, SkQs, XJB-5-131 и другие регулирующие функции митохондрий могут эффективно играть роль в регенерации межпозвоночных дисков. Бай и др. также пришел к такому же выводу. Они обнаружили, что гидрогелевый каркас, несущий рапамицин, может эффективно устранять компоненты активного кислорода в микроокружении межпозвонкового диска, тем самым играя роль в регенерации межпозвонкового диска Bai et al., 2020. Другое исследование показало, что кислоточувствительные ионные каналы (ASIC) как ключевые рецепторы внеклеточных протонов центральных и периферических нейронов связаны с дегенерацией межпозвонкового диска и снижением рН микросреды. Подавляя экспрессию ASIC2 и ASIC4 в МПД человека, он может замедлять старение клеток межпозвонкового диска. Несколько других исследований показали, что CCL25 Stich et al., 2018, колониестимулирующий фактор Abdel Fattah and Nasr El-Din, 2021, противовоспалительный препарат этанерцепт Li et al., 2020, хитозан/поли-γ -глутаматный нанокомплекс Cunha et al., 2020, HIF Kim et al., 2021, фактор-1α, полученный из стромальных клеток Zhang et al., 2018 и содержащие тромбоцитарную плазму Chang et al., 2020; Fiani et al., 2021 могут играть роль в регенерации межпозвонкового диска, ингибируя местную воспалительную среду. Как упоминалось ранее, некоторые клетки могут также стимулировать пролиферацию эндогенных стволовых клеток или клеток-предшественников, секретируя широкий спектр биологически активных факторов для производства нового ВКМ. Сан и др. обнаружили, что фактор роста соединительной ткани (CTGF) и TGF-β3 могут эффективно индуцировать соответствующие СККМ для дифференцировки в NP-подобные клетки и фибробластоподобные клетки и восстанавливать внеклеточный матрикс Sun et al., 2021. Кроме того, все больше и больше экспериментальных результатов показывают, что экзосомы, полученные из стволовых клеток, обладают потенциальными регенеративными способностями, способствуя пролиферации клеток, усиливая ангиогенез, способствуя восстановлению гомеостаза внеклеточного матрикса, подавляя воспаление и другие неизвестные эффекты Hingert et al., 2020; Hu et al. др., 2020. Некоторые из этих полезных механизмов также могут быть реализованы при восстановлении дегенерации межпозвонкового диска.
Кроме того, замена всего межпозвонкового диска считается одним из возможных методов регенерации всего межпозвонкового диска. На самом деле, давно исследователи изучили клинический эффект искусственно синтезированных межпозвонковых дисков, непосредственно заменяющих сильно дегенерированные межпозвонковые диски, но полученные результаты являются отрицательными, поскольку этот синтетический межпозвонковый диск учитывает только механические свойства межпозвонкового диска без учета био совместимости — этот продукт постепенно выводится из употребления. Однако в последние годы внимание исследователей привлекает гетерогенный децеллюляризированный каркас Hensley et al., 2018. Поскольку этот тип каркаса получен из тела крупного рогатого скота, беспокоиться о нехватке доноров нет необходимости. Из-за бесклеточной обработки он не обладает иммуногенностью и показал хорошие результаты во многих экспериментах на животных Fiordalisi et al., 2020; Norbertczak et al., 2020. Однако все млекопитающие, использованные в этих экспериментах, четвероногие, а позвоночник параллелен земле, поэтому нагрузка на их диски несопоставима с нагрузкой у человека. До сих пор никакие соответствующие клинические исследования не доказали, что бесклеточный каркас может эффективно заменить функцию естественного диска у человека.
Хотя большинство из вышеперечисленных стратегий регенерации достигли положительных результатов, большинство методов лечения можно применять только на ранних стадиях дегенерации межпозвонкового диска, потому что большинство исследований доказали, что, будь то терапия стволовыми клетками или терапия факторами роста, для поздней дегенерации , суровая местная среда межпозвонкового диска вызовет быструю потерю биологической активности вводимого вещества, а затем приведет к тому, что эти эффективные методы лечения не смогут достичь предполагаемых эффектов. Поэтому следует рассмотреть концепцию дегенерации межпозвонкового диска. Его следует рассматривать как заболевание, подобное диабету и гипертонии. Третичную профилактику следует начинать, начиная с первичной профилактики, такой как причина заболевания, и усиление рекламы и просвещения для информирования людей о серьезности заболевания и начала ранней профилактики. Однако в настоящее время, поскольку ранняя дегенерация межпозвонкового диска протекает бессимптомно и ее трудно обнаружить, текущие фундаментальные исследования требуют срочной разработки, чтобы найти биомаркеры ранней дегенерации межпозвонкового диска и своевременно вмешаться, избегая широко распространенного возникновения остеохондроза. боль в мире.
Хотя мы выступаем за раннее вмешательство, ранние симптомы слабо выражены, и большинство современных методов введения представляют собой местные инъекции. Это инвазивная операция, при которой повреждаются окружающие мышцы и капсула сустава. Если вы хотите ввести NP, это определенно повредит AF. Повреждение этих тканей может усугубить дегенерацию межпозвонкового диска, и остается неизученным, может ли терапевтический эффект, вызванный местным введением лекарств, компенсировать риск этого повреждения. Поэтому крайне важно найти лучший метод доставки лекарств с меньшей травмой.
Доклинические исследования биоматериалов для восстановления межпозвоночных дисков
В доклинических исследованиях восстановления межпозвонкового диска крысы являются наиболее распространенной животной моделью. Барселона и др. подготовили гидрогель, функционализированный пептидами, для изучения восстановления межпозвонкового диска Barcellona et al., 2021. Гель имеет жесткость, аналогичную жесткости дегенерированного студенистого ядра (~10 кПа), что способствует моделированию среды обитания клетки и играет определенную роль механической поддержки. После функционализации ламинин-миметическими пептидами IKVAV и AG73 он может снабжать доставленные клетки биомиметическими сигналами, чтобы стимулировать фенотипическую экспрессию и повышать биосинтетическую активность. В модели дегенерации межпозвонкового диска крыс также было подтверждено, что после того, как гель был объединен с первичными клетками NP, скорость удержания клеток и время выживания улучшились, а дегенерация значительно улучшилась.
В процессе восстановления межпозвонкового диска чрезмерная местная воспалительная реакция будет сильно препятствовать регенерации ткани межпозвонкового диска. Следовательно,эксперименты in vivo по подавлению воспалительной реакции, возникающей при дегенерации. Биан и др. разработали гидрогелевую микросферу с модулем упругости 25,23 ± 2,58 кПа, которая является достаточно жесткой, чтобы защитить клетки от силы сдвига во время инъекции и избежать других механических нагрузок во время применения. Затем гидрогелевые микросферы, нагруженные клетками NP и ингибиторами экспрессии провоспалительных факторов, вводили в дегенерированные межпозвонковые диски крыс. Было замечено, что снижение воспалительных факторов и увеличение активности пролиферации клеток, нагруженных NP, а также увеличение отложения внеклеточного матрикса способствовали регенерации межпозвонкового диска Bian et al., 2021. В то время как дегенерация межпозвонкового диска вызывает воспаление, наиболее актуальной проблемой, которую необходимо решить, является боль. Мохд Иса и др. разработали новую крысиную модель боли, вызванной повреждением межпозвонкового диска, и доказали, что гидрогель гиалуроновой кислоты может уменьшить воспаление при одновременном уменьшении боли, предоставив метод лечения боли в спине, вызванной дегенерацией межпозвонкового диска Mohd Isa et al., 2018.
Текущие исследования биоматериалов по-прежнему в основном основаны на экспериментах in vivo на мелких животных. Причина в том, что материалам трудно достичь достаточной механической прочности при сохранении биологической активности, а in vivoисследования на крупных животных в основном проводятся на искусственных межпозвонковых дисках, в которых большее внимание уделяется их долговременным механическим свойствам и долговечности. Шикинами и др. разработал гибкую систему искусственных межпозвонковых дисков. По сравнению с традиционной жесткой системой, состоящей из твердой пластины и материала сердцевины, она была проверена на павианах на предмет ее долговечности и биосовместимости. При этом он имитирует движение межпозвонковых дисков человека. Механические испытания также доказали, что срок службы нормального человека может достигать более 50 лет Shkinami et al., 2010. Текущие клинические исследования альтернативного лечения дегенерации межпозвоночных дисков в основном представляют собой полную замену диска, и различные материалы искусственного диска оказывают определенное влияние на клиническую эффективность Coban et al., 2021. В то же время высокая частота рецидивов и неясные факторы риска вторичной хирургии также ограничивают развитие хирургии Perfetti et al., 2021. Клиническая трансформация искусственных межпозвонковых дисков еще нуждается в более глубоких и длительных исследованиях.
Заключительные замечания и перспективы на будущее
Мы рассматриваем современные подходы к восстановлению дегенеративных межпозвоночных дисков на основе биоматериалов, включая замену дисков, клеточную терапию и генную терапию. Таблицы 1 – 3 обобщает биоматериалы, используемые в различных методах восстановления межпозвоночных дисков, и их функции восстановления. Ранние исследования были сосредоточены на восстановлении структуры межпозвонкового диска и игнорировали взаимодействие между клетками, поэтому вероятность успеха восстановления межпозвонкового диска была невысокой. В более позднем исследовании многие исследователи начали уделять пристальное внимание использованию клеточной терапии для ослабления и восстановления дегенерации межпозвонкового диска, главным образом потому, что большинство клеток являются мезенхимальными стволовыми клетками или клетками межпозвонкового диска. Благодаря биомиметическому ВКМ или форме в среду формирования ВКМ способствуют пролиферации и дифференцировке клеток, таким образом, достигается эффект восстановления межпозвонкового диска. Хотя генная терапия использует вирусные векторы для лечения остеохондроза и достигла определенных результатов, основные проблемы этого метода включают канцерогенез и иммунный ответ.
Следовательно, невирусные генные векторы являются предпочтительной системой доставки, хотя эффективность трансфекции ниже, чем у вирусных векторов. Реставрационные материалы для дегенерации межпозвонкового диска в основном включают водный гель, нановолокно и т. Д., С помощью комбинации можно имитировать естественную регенерацию ткани межпозвонкового диска NP в исследовании, обычно имеющую характеристики, аналогичные эластомерным материалам натурального NP, и при восстановлении регенерации AF, больше заботится о прочности материала, цель состоит в том, чтобы сформировать хороший эффект герметизации и предотвратить грыжу NP снова. Одновременно было проведено множество исследований по восстановлению хрящевой замыкательной пластинки. Поскольку замыкательная пластинка влияет на питательный и метаболический обмен межпозвонкового диска после имплантации материала, интеграция поверхности замыкательной пластинки с NP и AF также важна. Конкретный метод заключается в формировании хрящевого слоя за счет способности материала к хондрогенной дифференциации, а затем слиянии с NP или AF для достижения контакта с поверхностью. В противном случае накопление метаболических отходов и дефицит питательных веществ приведут к нарушению процесса восстановления. На самом деле дегенерация диска — это не единичная дегенерация, а изменение биологического окружения НП, ФП или хрящевой замыкательной пластинки.
Поэтому метод восстановления должен быть многогранным, чтобы полностью устранить симптомы. В настоящее время биоматериалы для восстановления межпозвонковых дисков стали обладать многогранными восстановительными функциями, Ожидается, что эта комбинированная стратегия восстановления приведет к полному восстановлению межпозвонковых дисков. Однако, в частности, исследования материалов для регенерации межпозвонковых дисков все еще сталкиваются со многими проблемами. Требования к материалам с механическими свойствами соответствуют естественной ткани межпозвонкового диска, и после достижения длительной физической нагрузки они все еще могут сохранять высокий уровень своей структуры и функции. В то же время материалы также должны иметь возможность интегрировать концевые пластины хряща для достижения плавного обмена питательными веществами и обмена веществ. Кроме того, патофизиологически, нарушения циркадного ритма, апоптоз клеток межпозвонкового диска и старение. Такие проблемы, как аномальная аутофагия воспалительной реакции, также создают большие проблемы для восстановления диска с помощью биоматериала.
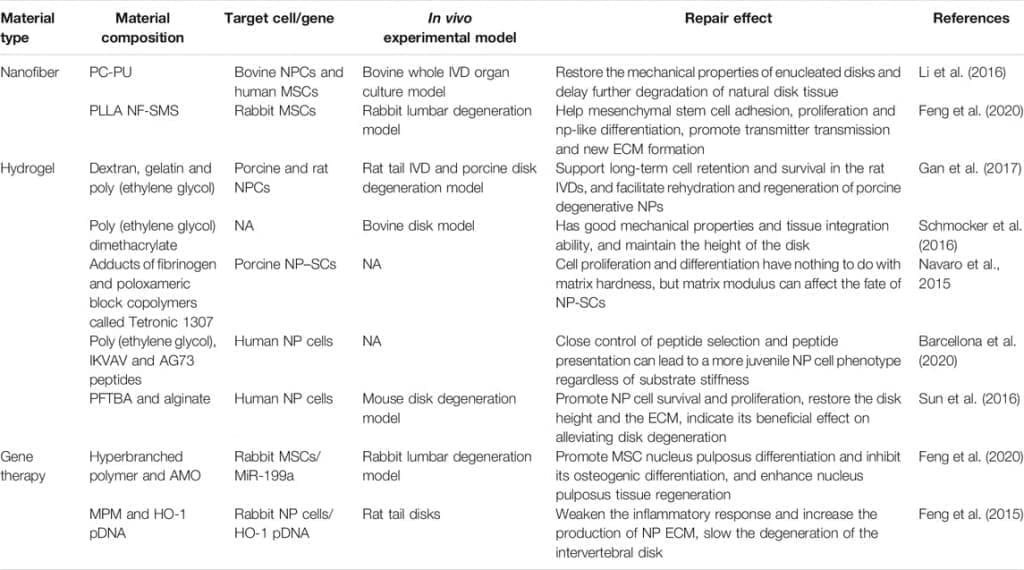
ТАБЛИЦА 1. Краткое изложение различных биоматериалов для восстановления студенистого ядра и их функций
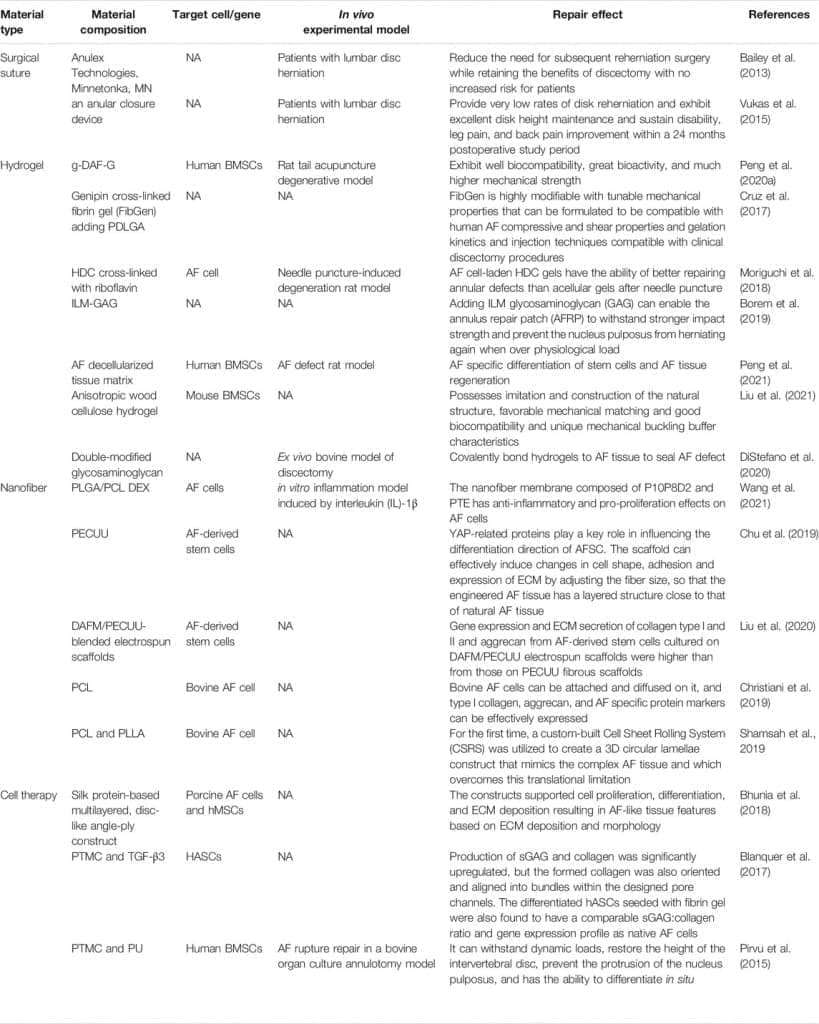
ТАБЛИЦА 2. Обзор различных биоматериалов для восстановления ФП и их функций

ТАБЛИЦА 3. Краткое изложение различных биоматериалов для восстановления замыкательной пластинки хряща и их функций
Успехи и перспективы биоматериалов для регенерации межпозвонковых дисков
Однако стрессовые изменения, вызванные традиционной хирургией спондилодеза, склонны к дегенерации соседних сегментов, в то время как хирургия без спондилодеза имеет проблемы, такие как окостенение искусственных межпозвонковых дисков. Для преодоления этих недостатков крайне необходимы биоматериалы, способные эндогенно регенерировать межпозвонковый диск и восстанавливать биомеханическую функцию межпозвонкового диска. Межпозвонковый диск представляет собой фиброзно-хрящевую ткань, состоящую в основном из студенистого ядра и фиброзного кольца. Студенистое ядро (NP) содержит большое количество воды и протеогликанов. и его основная функция — поглощать сжимающие силы и распределять нагрузки от физических нагрузок на другие части тела. Фиброзное кольцо (AF) представляет собой многослойную структуру, которая окружает NP, состоит из воды и коллагена и поддерживает напряжение сжатия и сдвига во время сложных движений. Следовательно, для функционального восстановления НП и ФП необходимы различные биоматериалы и стратегии тканевой инженерии в зависимости от их структуры и функции.
В последнее время достигнуты большие успехи в биоматериалах для НЧ и АЖ из функциональных полимеров, таких как хитозан, коллаген, полимолочная кислота и поликапролактон. Однако скаффолды, регенерирующие межпозвонковый диск, остаются неизученными. Следовательно, несколько стратегий тканевой инженерии, основанных на трансплантации клеток и факторах роста, были тщательно исследованы. В этом обзоре мы суммировали функциональные полимеры и стратегии тканевой инженерии NP и AF для эндогенной регенерации дегенеративного межпозвонкового диска. Также обсуждались перспективы и проблемы стратегий тканевой инженерии с использованием функциональных полимеров, трансплантации клеток и факторов роста для создания дегенеративных межпозвонковых дисков.
Материал взят с сайта https://www.frontiersin.org/articles/10.3389/fbioe.2021.766087/full