Коллаген является наиболее распространенным белком у животных. Этот волокнистый структурный белок включает правый пучок из трех параллельных левых полипролиновых спиралей II типа. Был достигнут значительный прогресс в выяснении структуры тройных спиралей коллагена и физико-химических основ их стабильности. Новые данные показывают, что стереоэлектронные эффекты и преорганизация играют ключевую роль в этой стабильности. Подробно раскрыта фибриллярная структура коллагена I типа – прототипа коллагеновой фибриллы. Искусственные коллагеновые фибриллы, обладающие некоторыми свойствами натуральных коллагеновых фибрилл, теперь доступны с помощью химического синтеза и самосборки. Быстро развивающееся понимание механических и структурных свойств нативных коллагеновых фибрилл будет способствовать дальнейшей разработке искусственных коллагеновых материалов для биомедицины и нанотехнологий.
СТРУКТУРА И СТАБИЛЬНОСТЬ КОЛЛАГЕНА
Внеклеточный матрикс (ECM) представляет собой высоко динамическую и гетерогенную структуру, которая играет множество ролей в живых организмах. Его целостность и гомеостаз имеют решающее значение для нормального развития тканей и физиологии органов. Утрата или изменение компонентов ВКМ оборачивается исходом заболевания. В этом обзоре мы даем общий обзор компонентов ВКМ, уделяя особое внимание коллагенам, наиболее распространенным и разнообразным молекулам ВКМ. Мы обсуждаем различные функции ECM, включая его влияние на пролиферацию, миграцию и дифференцировку клеток, подчеркивая актуальность двунаправленных взаимодействий между матрицей и окружающими клетками. Систематически рассматривая все наследственные нарушения, связанные с измененной структурой коллагена или приводящие к чрезмерной деградации коллагена, мы указываем на функциональную значимость коллагена и, следовательно, элементов внеклеточного матрикса для здоровья человека. Более того, большой перекрывающийся спектр клинических признаков нарушений, связанных с коллагеном, в некоторых случаях делает клиническую диагностику пациентов очень сложной. Лучшее понимание сложности ВКМ и молекулярных механизмов, регулирующих экспрессию и функции различных элементов ВКМ, будет иметь основополагающее значение для полного распознавания различных клинических состояний.Коллаген является распространенным структурным белком у всех животных. У человека коллаген составляет одну треть от общего белка, составляет три четверти сухого веса кожи и является наиболее распространенным компонентом внеклеточного матрикса (ECM). У позвоночных идентифицировано 28 различных типов коллагена, состоящего как минимум из 46 различных полипептидных цепей, и многие другие белки содержат коллагеновые домены. Примечательно, что неповрежденный коллаген был обнаружен в мягких тканях окаменелых костей окаменелости тираннозавра рекса возрастом 68 миллионов лет, что на сегодняшний день является самым старым белком, обнаруженным на сегодняшний день. Это открытие, однако, подвергается сомнению.
Определяющей особенностью коллагена является элегантный структурный мотив, в котором три параллельные полипептидные нити в левосторонней спиральной конформации полипролина II типа (PPII) закручиваются друг вокруг друга со смещением одного остатка, образуя правостороннюю тройную спираль Рисунок 1. Плотная упаковка спиралей PPII в тройной спирали требует, чтобы каждый третий остаток был Gly, что приводит к повторяющейся последовательности XaaYaaGly, где Xaa и Yaa могут быть любой аминокислотой. Этот повтор встречается во всех типах коллагена, хотя он нарушен в определенных местах в домене тройной спирали нефибриллярных коллагенов. Аминокислоты в положениях Xaa и Yaa коллагена часто представляют собой (2S)-пролин (Pro, 28%) и (2S, 4R)-4-гидроксипролин (Hyp, 38%) соответственно. ProHypGly является наиболее распространенным триплетом (10, 5%) в коллагене. У животных отдельные тройные спирали коллагена, известные как тропоколлаген (ТК), собираются сложным иерархическим образом, что в конечном итоге приводит к макроскопическим волокнам и сетям, наблюдаемым в тканях, костях и базальных мембранах (рис. 2).
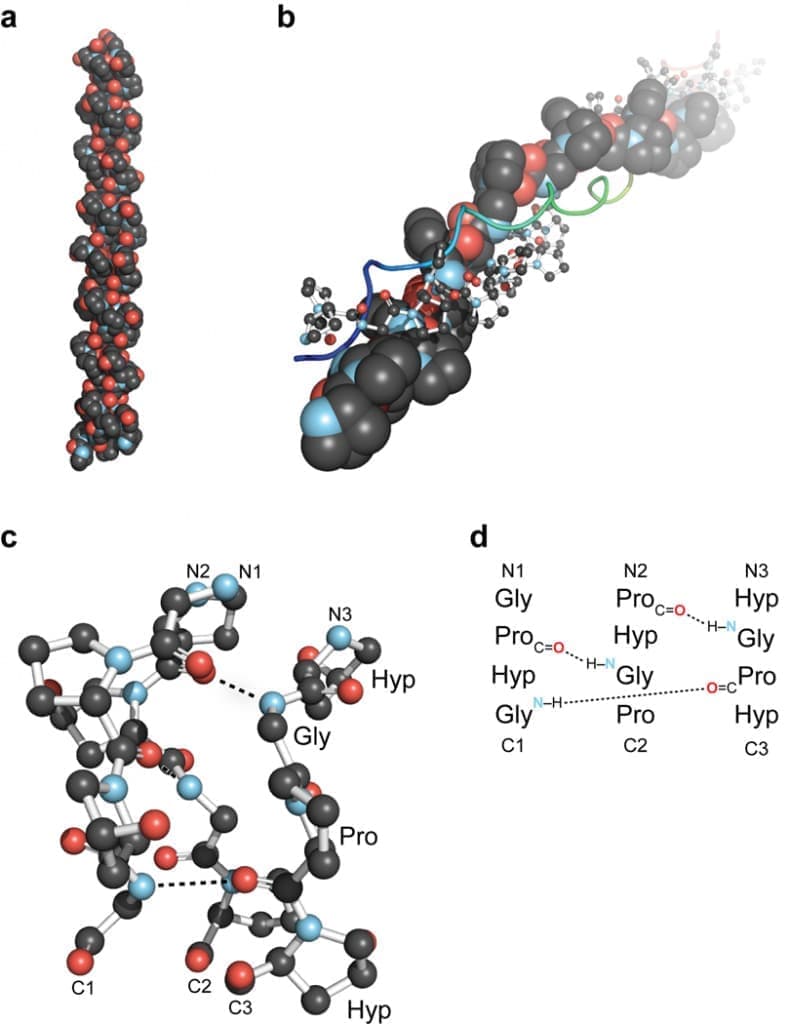
Рисунок 1 .Обзор тройной спирали коллагена. (а) Первая кристаллическая структура тройной спирали коллагена с высоким разрешением, образованная из (ProHypGly) 4–(ProHypAla)–(ProHypGly) 5 [Банк данных белков (PDB), запись 1cag]. (b) Вид вниз по оси тройной спирали (ProProGly)10 [запись PDB 1k6f] с тремя нитями, изображенными в виде заполнения пространства, шарика и палочки и ленты. (c) Шаровидное изображение сегмента тройной спирали коллагена [запись PDB 1cag], выделяющее лестницу межцепочечных водородных связей. (d) Смещение трех нитей в сегменте на панели c.
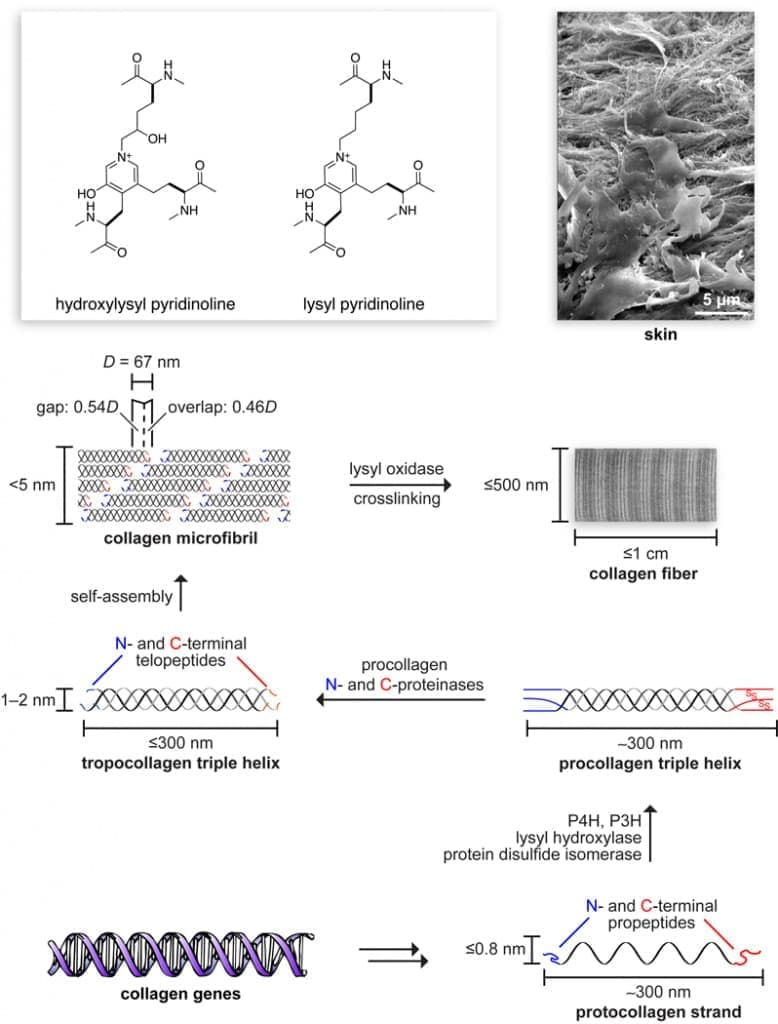
Рисунок 2. Путь биосинтеза к коллагеновым волокнам, которые являются основным компонентом кожи. Размер и сложность увеличиваются за счет посттрансляционных модификаций и самосборки. Окисление боковых цепей лизина приводит к спонтанному образованию поперечных связей гидроксилизилпиридинолина и лизилпиридинолина.
Категории коллагена включают классические фибриллярные и сеткообразующие коллагены, FACIT (коллагены, связанные с фибриллами, с прерванными тройными спиралями), MACIT (коллагены, связанные с мембранами, с прерванными тройными спиралями) и MULTIPLEXIN (множественные домены тройной спирали и прерывания). Типы коллагенов, их распределение, состав и патология перечислены в табл. 1. Следует отметить, что, хотя три полипептидные цепи в тройной спирали каждого типа коллагена могут быть идентичными, гетеротримерные тройные спирали превалируют чаще, чем гомотримерные тройные спирали.
| Type | Class | Composition | Distributionb | Pathologyc |
|---|---|---|---|---|
| I | Fibrillar | α1[I]2α2[I] |
Abundant and widespread: dermis, bone, tendon, ligament |
OI, Ehlers–Danlos syndrome, osteoporosis |
| II | Fibrillar | α1[II]3 | Cartilage, vitreous |
Osteoarthrosis, chondrodysplasias |
| III | Fibrillar | α1[III]3 |
Skin, blood vessels, intestine |
Ehlers–Danlos syndrome, arterial aneurysms |
| IV | Network |
α1[IV]2α2[IV] α3[IV]α4[IV]α5[IV] α5[IV]2α6[IV] |
Basement membranes |
Alport syndrome |
| V | Fibrillar |
α1[V]3 α1[V]2α2[V] α1[V]α2[V]α3[V] |
Widespread: bone dermis, cornea, placenta |
Ehlers–Danlos syndrome |
| VI | Network |
α1[VI]α2[VI]α3[VI]d α1[VI]α2[VI]α4[VI] |
Widespread: bone, cartilage, cornea, dermis |
Bethlem myopathy |
| VII |
Anchoring fibrils |
α1[VII]2α2[VII] | Dermis, bladder |
Epidermolysis bullosa acquisita |
| VIII | Network |
α1[VIII]3 α2[VIII]3 α1[VIII]2α2[VIII] |
Widespread: dermis, brain, heart, kidney |
Fuchs endothelia corneal dystrophy |
| IX | FACITe | α1[IX]α2[IX]α3[IX] |
Cartilage, cornea, vitreous |
Osteoarthrosis, multiple epiphyseal dysplasia |
| X | Network | α1[X]3 | Cartilage | Chondrodysplasia |
| XI | Fibrillar | α1[XI]α2[XI]α3[XI] |
Cartilage, intervertebral disc |
Chondrodysplasia, osteoarthrosis |
| XII | FACIT | α1[XII]3 | Dermis, tendon | — |
| XIII | MACIT | — |
Endothelial cells, dermis, eye, heart |
— |
| XIV | FACIT | α1[XIV]3 |
Widespread: bone dermis, cartilage |
— |
| XV | MULTIPLEXIN | — |
Capillaries, testis kidney, heart, |
— |
| XVI | FACIT | — | Dermis, kidney | — |
| XVII | MACIT | α1[XVII]3 |
Hemidesmosomes in epithelia |
Generalized atrophic epidermolysis bullosa |
| XVIII | MULTIPLEXIN | — |
Basement membrane, liver |
Knobloch syndrome |
| XIX | FACIT | — |
Basement membrane |
— |
| XX | FACIT | — | Cornea (chick) | — |
| XXI | FACIT | — | Stomach, kidney | — |
| XXII | FACIT | — | Tissue junctions | — |
| XXIII | MACIT | — | Heart, retina | — |
| XXIV | Fibrillar | — | Bone, cornea | — |
| XXV | MACIT | — | Brain, heart, testis |
Amyloid formation? |
| XXVI | FACIT | — | Testis, ovary | — |
| XXVII | Fibrillar | — | Cartilage | — |
| XXVIIIf | — | — |
Dermis, sciatic nerve |
Neurodegenerative disease? |
Таблица 1. а, b: Частичный список тканей, в которых встречается соответствующий тип коллагена. cДля обсуждения роли определенных типов коллагена в заболеваниях человека. Цепи dα4[VI], α5[VI] и α6[VI] были описаны в 2008 г., но состав тройных спиралей, содержащих α5[VI] и α6[VI], неизвестен. eСокращения: FACIT, коллаген, связанный с фибриллами, с прерванными тройными спиралями; MACIT, ассоциированный с мембраной коллаген с прерванными тройными спиралями; МУЛЬТИПЛЕКСИН, несколько доменов тройной спирали и прерывания. fКоллаген XXVIII был зарегистрирован в 2006 году.
СТРУКТУРА ТРОЙНОЙ СПИРАЛИ КОЛЛАГЕНАВ
1940 г. Astbury и Bell предположили, что молекула коллагена состоит из одной вытянутой полипептидной цепи со всеми амидными связями в цис-конформации. Значительный прогресс был достигнут, когда в том же выпуске Proceedings of the National Academy of Sciences за 1951 г., в котором он и его коллеги представили правильные структуры для α-спирали и β-листа, Полинг и Кори предложили структуру для коллагена. В этой структуре три полипептидные цепи удерживались вместе в спиральной конформации водородными связями. В каждом триплете аминокислот эти водородные связи задействуют четыре из шести гетероатомов основной цепи, и для их образования требуется, чтобы две из трех пептидных связей находились в цис-конформации. В 1954 г. Ramachandran и Kartha разработали структуру тройной спирали коллагена на основе данных дифракции волокон. Их структура представляла собой правую тройную спираль из трех расположенных в шахматном порядке, левых спиралей PPII со всеми пептидными связями в транс-конформации и двумя водородными связями в каждом триплете. В 1955 году эта структура была уточнена Ричем и Криком и Нортом с сотрудниками до принятой сегодня структуры тройной спирали–, которая имеет одну межцепочечную структуру N–H(Gly)⋯O=C( Xaa) водородная связь на триплет и десятикратная спиральная симметрия с осевым повтором 28,6 Å (шаг спирали 10/3) (рис. 1).Дифракционные исследования волокон не могут выявить структуру коллагена с атомарным разрешением. Усугубляя эту трудность, большой размер, нерастворимость, повторяющаяся последовательность и сложная иерархическая структура нативного коллагена препятствуют проведению большинства биохимических и биофизических анализов. Следовательно, с конца 1960-х годов широко применяется редукционистский подход с использованием трехспиральных пептидов, родственных коллагену (CRP).
В 1994 г. Берман и его коллеги сообщили о первой кристаллической структуре тройной спирали CRP с высоким разрешением (рис. 1а). Эта структура подтвердила существование межцепочечных водородных связей N–H(Gly)⋯O=C(Xaa) (рис. 1c,d) и дала дополнительные сведения, в том числе о том, что Cα–H(Gly/Yaa)⋯O=C(Xaa/ Gly) водородные связи также могут стабилизировать тройную спираль. С помощью CRP и рентгеновской кристаллографии наблюдалось структурное влияние одной замены Gly → Ala, анализировались эффекты соседних заряженных остатков в тройной спирали и моментальный снимок взаимодействия тройной был получен спиральный CRP с I– доменом интегрина α2β1 (рис. 3).
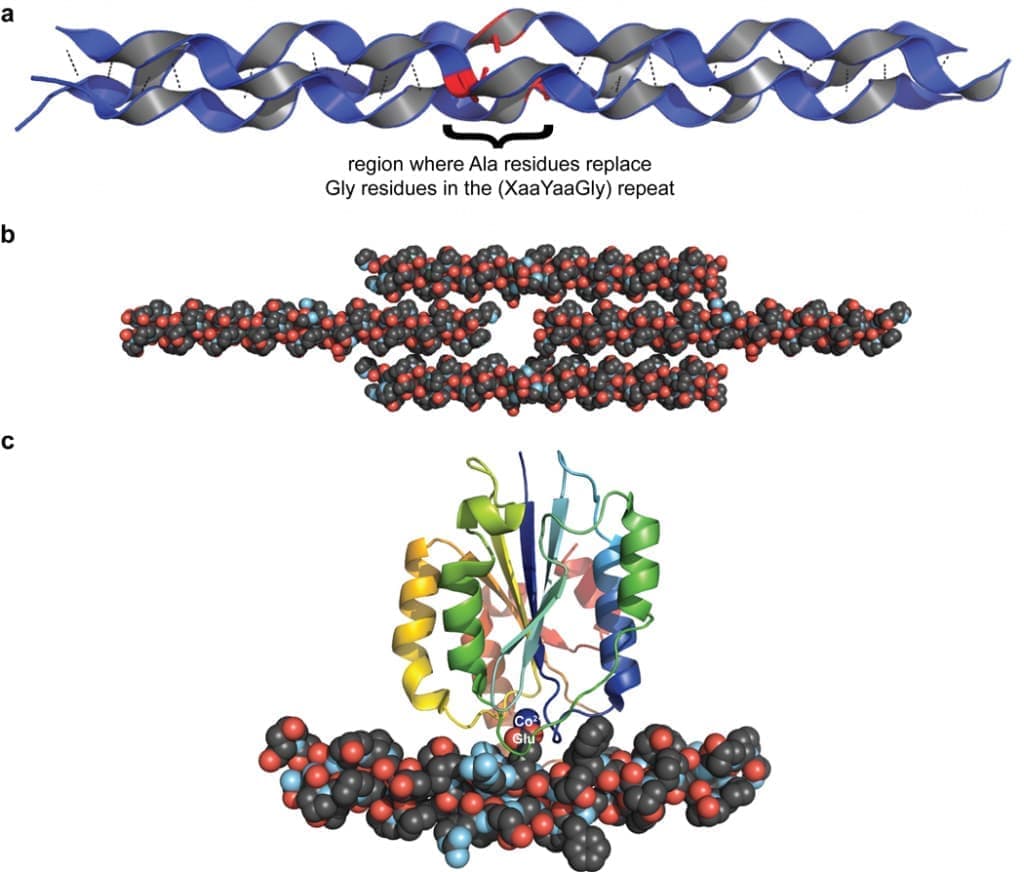
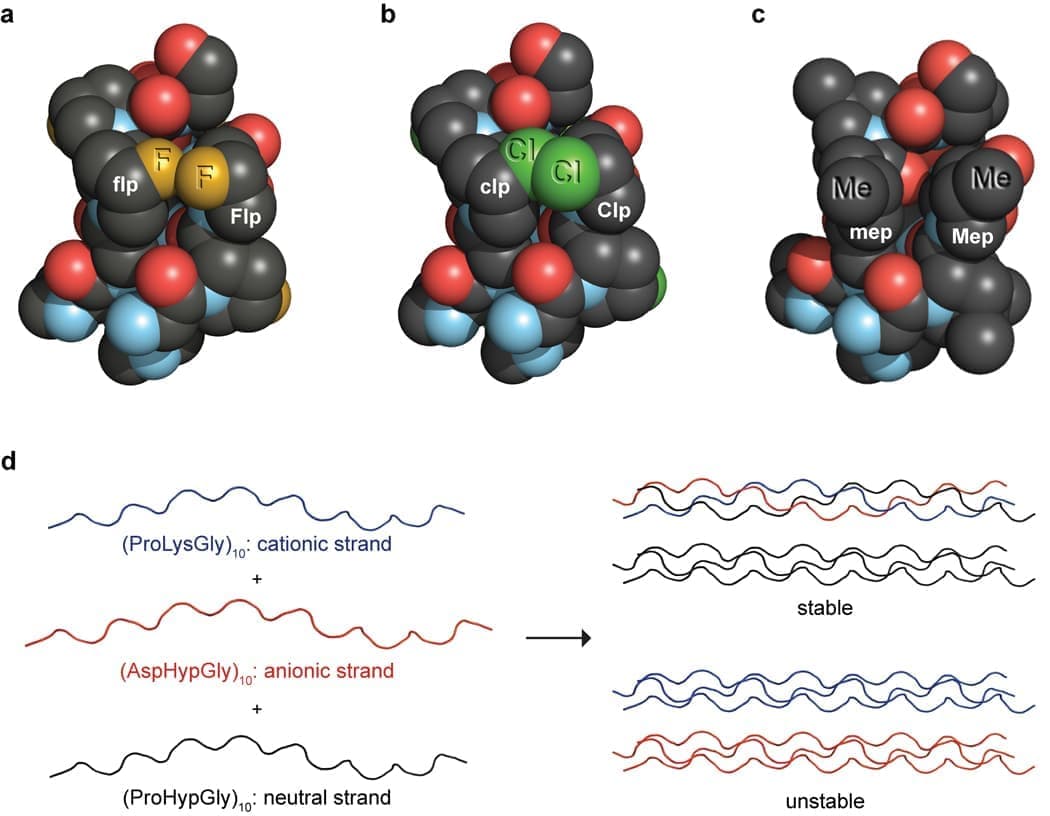
Рисунок 3. Снимки интересных кристаллических структур тройных спиралей коллагена.
(а) Влияние замены Gly→Ala на структуру тройной спирали коллагена, образованной коллагеноподобным пептидом (CRP) (ProHypGly)4–(ProHypAla)–(ProHypGly)5 [Protein Data Bank (PDB), запись 1cag]. Остатки Ala (красные) нарушают структуру. Мутации, приводящие к таким структурным аномалиям, часто встречаются при несовершенном остеогенезе и могут привести к летальному исходу. (b) Изображение влияния одиночного триплета GluLysGly на упаковку соседних трехспиральных CRP в кристаллическом (ProHypGly)4–(GluLysGly)–(ProHypGly)5 [запись PDB 1qsu]. Осевое смещение отдельных тройных спиралей, которое, по-видимому, вызвано вредными кулоновскими взаимодействиями между заряженными остатками, напоминает D-периодическую структуру коллагеновых фибрилл. Подобные взаимодействия могут способствовать морфологии коллагеновых фибрилл. (c) Трехспиральный CRP, содержащий интегрин-связывающий домен GFOGER в комплексе с I-доменом интегрина α2β1 [запись PDB 1dzi]. Считается, что изгиб тройной спирали возникает в результате взаимодействия белок-белок. Остаток Glu в средней цепи тройной спирали координируется с Co (II) (синий), связанным в домене I интегрина α2β1.
Большинство рентгеноструктурных исследований CRP было выполнено на коллагеновых последовательностях, богатых пролином. Все полученные структуры имеют шаг спирали 7/2 (осевой повтор 20,0 Å), в отличие от шага спирали 10/3 (осевой повтор 28,6 Å), предсказанного для природного коллагена с помощью дифракции волокон. На основе рентгеновских кристаллических структур богатых пролином CRP и в соответствии с ранним предложением относительно шага спирали природных тройных спиралей Окуяма и его коллеги постулировали, что правильный средний шаг спирали для природного коллагена составляет 7/2. Общность этой гипотезы неясна, так как немногие области природного коллагена так же богаты пролином, как CRP, проанализированные с помощью рентгеновской кристаллографии. Фактический шаг спирали коллагена, вероятно, варьируется в зависимости от доменов и типов природного коллагена. В частности, шаг спирали может составлять 10/3 в областях с низким содержанием пролина и 7/2 в областях с высоким содержанием пролина. Это предположение подтверждается наблюдением, что бедные пролином области внутри кристаллических CRP иногда обнаруживают шаг спирали 10/3. Вариабельность шага тройной спирали нативного коллагена может играть роль во взаимодействии коллагеновых доменов с другими биомолекулами.
ПОНИМАНИЕ ТРОЙНОЙ СПИРАЛЬНОЙ СТРУКТУРЫ И СТАБИЛЬНОСТИ
Жизненно важное значение коллагена в качестве каркаса для животных требует множества существенных характеристик. Эти характеристики включают термическую стабильность, механическую прочность и способность вступать в специфические взаимодействия с другими биомолекулами. Понимание того, как такие свойства обусловлены фундаментальной структурной единицей коллагена, тройной спиралью, требует всестороннего знания механизмов, лежащих в основе структуры и стабильности тройной спирали.Межнитевые водородные связи
Повсеместное распространение коллагена делает лестницу повторяющихся водородных связей N–H(Gly)⋯O=C(Xaa), которые образуют внутри тройной спирали (рис. 1c, d), наиболее распространенную амидно-амидную водородную связь в царстве Animalia. Замена амидной связи Yaa-Gly сложным эфиром в CRP хозяин-гость (рис. 4a,b) позволила оценить прочность каждой водородной связи амид-амид как ΔG° = -2,0 ккал/моль. Борискина и коллеги использовали множество других экспериментальных методов для оценки того же параметра, оценивая прочность каждой амид-амидной водородной связи в поли(GlyProPro) CRP как ΔG° = -1,8 ккал/моль и в нативном коллагене как ΔG° = -1,4 ккал/моль.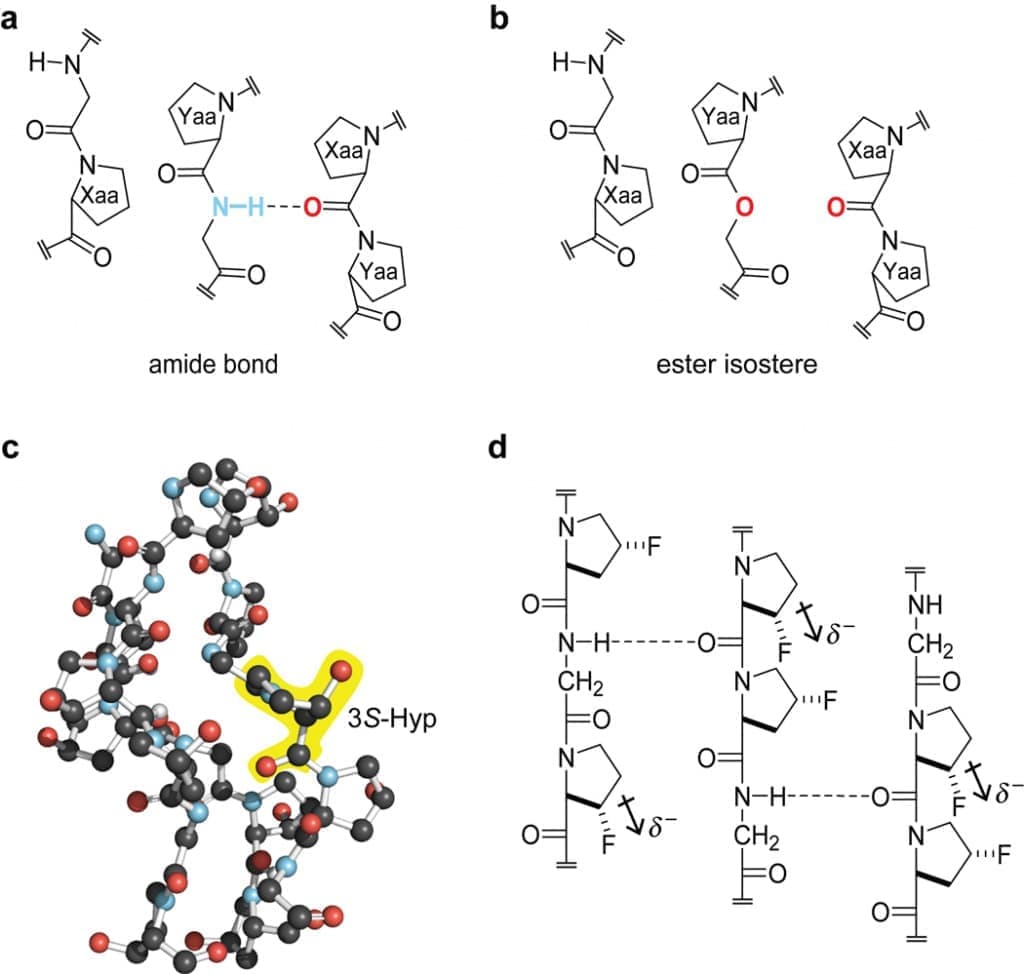
Рисунок 4. Важность межцепочечных водородных связей для стабильности тройной спирали коллагена. (а) Сегмент тройной спирали (ProProGly)10. (b) Сравнение стабильности тройной спирали, образованной из (ProProGly)4–ProProOGly–(ProProGly)5, в которой одна амидная связь Pro–Gly заменена на сложноэфирную, со стабильностью на панели а показало, что каждая межцепочечная водородная связь вносит свой вклад ΔG = -2,0 ккал/моль для стабильности тройной спирали. ( c ) Кристаллическая структура тройной спирали, образованной из родственного коллагену пептида, который имитирует общую последовательность в коллагене типа IV, (GlyProHyp)3–(3S-HypHypGly)2–(GlyProHyp)4, показывая, что 3S-Hyp в Положение Xaa дает прототип тройной спирали коллагена [запись PDB 2g66 (78)]. (d) (2S,3S)-3-фторпролин в положении Xaa дестабилизирует тройную спираль коллагена, возможно, за счет уменьшения электронной плотности у проксимального карбонила Xaa и, таким образом, снижения прочности межцепочечной водородной связи.
Мутации глицина
Многочисленные заболевания, связанные с коллагеном, связаны с мутациями как в тройных, так и в нетройных спиральных доменах различных коллагенов (таблица 1). Остаток Gly в повторе XaaYaaGly инвариантен в природном коллагене, а благоприятные замены неизвестны в CRP. Компьютерное исследование показало, что замена обязательных остатков Gly в коллагене на d-аланин или d-серин стабилизирует тройную спираль и, таким образом, остатки Gly в коллагене являются заменителями неприродных d-аминокислот. Однако последующие экспериментальные данные показали, что это представление было ошибочным.Многие из наиболее разрушительных мутаций генов коллагена приводят к замене остатка Gly, участвующего в лестнице водородных связей внутри тройной спирали (рис. 1c, d). Как идентичность аминокислоты, заменяющей Gly, так и место этой замены могут влиять на патологию, например, несовершенного остеогенеза (НО). Замены Gly в богатых пролином участках коллагеновой последовательности (рис. 3а) гораздо менее разрушительны, чем замены в участках с низким содержанием пролина, что свидетельствует о важности производных Pro для зародышеобразования тройной спирали. In vivo тройные спирали сворачиваются С-концевым → N-концевым образом. Временная задержка между нарушением укладки тройной спирали заменой Gly и повторным зародышеобразованием процесса укладки на N-конце по отношению к сайту замены намного короче, когда зародышевые последовательности тройной спирали, богатые пролином, находятся непосредственно на N-конце по отношению к сайту замены. Любая задержка в сворачивании тройной спирали приводит к сверхмодификации цепей протоколлагена [в частности, к чрезмерному гидроксилированию остатков Lys на N-конце по отношению к замене Gly и чрезмерному гликозилированию образующихся остатков гидроксилизина (рис. 2)], тем самым нарушая тройную спиральную структуру и способствуя тяжести OI. Т.о., тяжесть OI коррелирует с обилием зародышей тройной спирали, богатых пролином последовательностей, непосредственно N-концевых к сайту замены.
Пролины в позициях Xaa и Yaa
В нитях человеческого коллагена примерно 22% всех остатков относятся либо к Pro, либо к Hyp. Обилие этих остатков предварительно организует отдельные нити в конформацию PPII, тем самым снижая энтропийные затраты на укладку коллагена. Несмотря на свои стабилизирующие свойства, производные Pro также имеют определенные вредные последствия для укладки тройной спирали и стабильности, которые частично компенсируют их благоприятные эффекты. Например, Pro имеет вторичную аминогруппу и образует третичные амиды внутри пептида или белка. Третичные амиды имеют значительную популяцию как транс-, так и цис-изомеров (рис. 5), тогда как все пептидные связи в коллагене являются транс-изомерами. Таким образом, прежде чем цепь (ProHypGly)n сможет свернуться в тройную спираль, все цис-пептидные связи должны изомеризоваться в транс- N-метилаланин (ациклический третичный амид, в котором отсутствует только Cγ Pro) снижает стабильность тройной спирали при использовании вместо Pro или Hyp в CRP, предположительно из-за отсутствия преорганизации, обусловленной пирролидиновым кольцом производных Pro. Напротив, полное устранение проблемы цис-транс-изомеризации путем замены амидной связи Gly-Pro транс-замкнутой изостерой алкена также приводит к дестабилизации тройной спирали, несмотря на то, что все межцепочечные водородные связи остаются нетронутыми. Ясно, что факторы, определяющие структуру и стабильность тройной спирали, сложным образом переплетаются.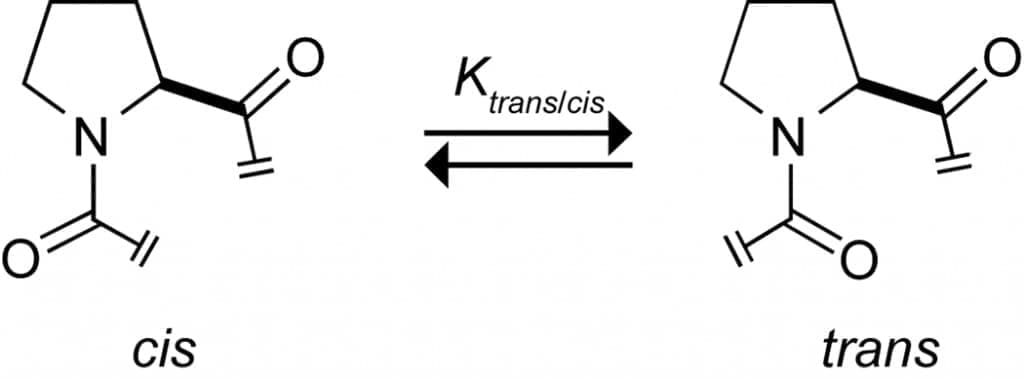
Рисунок 5. Цис-транс-изомеризация. В отличие от других протеиногенных аминокислот, Pro образует третичные амидные связи, что приводит к значительной популяции цис-конформации.
Остатки Pro в положении Yaa триплетов протоколлагена модифицируются пролил-4-гидроксилазой (P4H), ферментом негемового железа, который катализирует посттрансляционное и стереоселективное гидроксилирование неактивированного γ-углерода остатков Pro в положении Yaa последовательностей коллагена с образованием Hyp. (Рисунок 6). Активность P4H необходима для жизнеспособности как нематоды Caenorhabditis elegans, так и мыши Mus musculus. Таким образом, Hyp необходим для образования здорового коллагена in vivo.
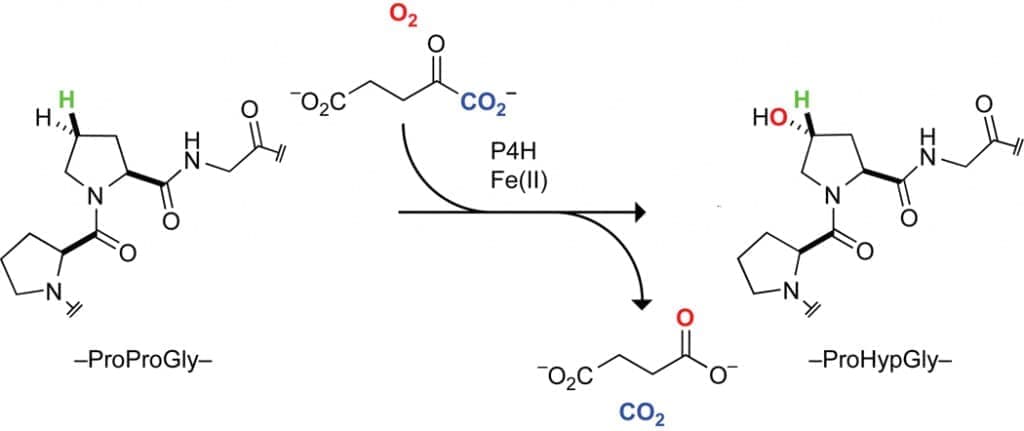
Рисунок 6. Реакция, катализируемая пролил-4-гидроксилазой (P4H). Остатки Pro в положении Yaa нитей коллагена превращаются в Hyp перед образованием тройной спирали.
Роль Хайпа
Гидроксилирование остатков Pro в положении Yaa коллагена резко повышает термостабильность тройных спиралей (табл. 2). Эта стабилизация происходит, когда полученный Hyp находится в положении Yaa, но не в положении Xaa, а также когда гидроксильная группа установлена в конфигурации 4S, как в (2S,4S)-4-гидроксипролине (hyp) ( Таблица 2). Эти находки привели к предположению, что конфигурация 4R пролильной гидроксильной группы является привилегированной только потому, что она обеспечивает образование опосредованных водой водородных связей, которые сшивают вместе свернутую тройную спираль. Действительно, такие водные мостики между Hyp и гетероатомами основной цепи наблюдались Berman и его коллегами в их фундаментальных рентгеноструктурных исследованиях CRP. Однако частота Hyp в большинстве натуральных коллагенов слишком мала, чтобы поддерживать разветвленную сеть водных мостиков. Например, четыре или более повторяющихся триады Xaa-Hyp-Gly встречаются только дважды в аминокислотной последовательности коллагена I типа человека.| (XaaYaaGly)n | Tm (°C) a | References |
|---|---|---|
| (ProFlpGly)7 | 45 | ( 54) |
| (ProHypGly)7 | 36 | ( 54) |
| (mepMepGly)7 | 36 | ( 65) |
| (flpProGly)7 | 33 | ( 68) |
| (ProMepGly)7 | 29 | ( 65) |
| (ProClpGly)7 | 23 | ( 61) |
| (mepProGly)7 | 13 | ( 65) |
| (clpProGly)7 | No helix | ( 61) |
| (ProProGly)7 | No helix | ( 79) |
| (flpFlpGly)7 | No helix | ( 79) |
| (ProflpGly)7 | No helix | ( 54) |
| (FlpProGly)7 | No helix | ( 68) |
| (ProFlpGly)10 | 91 | ( 53) |
| (ProMopGly)10 | 70 | ( 59) |
| (HypHypGly)10 | 65 | ( 85) |
| (ProHypGly)10 | 61–69 | ( 53, 85) |
| (flpProGly)10 | 58 | ( 69) |
| (ProClpGly)10 | 52 | ( 61) |
| (clpProGly)10 | 33 | ( 61) |
| (ProProGly)10 | 31–41 | (53, 64) |
| (flpFlpGly)10 | 30 | ( 94) |
| (clpClpGly)10 | No helix | ( 61) |
| (HypProGly)10 | No helix | ( 84) |
| (ProhypGly)10 | No helix | ( 47) |
| (FlpProGly)10 | No helix | ( 69) |
| (ClpProGly)10 | No helix | ( 61) |
| (hypProGly)10 | No helix | ( 47) |
Таблица 2. Значения Tm для трехспиральных CRP
Гипотеза о том, что водяные мостики, наблюдаемые в тройных спиралях кристаллов (ProHypGly)n, имеют смысл, была проверена путем замены остатков Hyp в CRP на (2S,4R)-4-фторпролин (Flp). Поскольку группы фтора не образуют сильных водородных связей, водные мостики не могут играть главную роль в стабилизации тройной спирали (ProFlpGly)10. Тем не менее тройные спирали (ProFlpGly)10 гиперстабильны (табл. 2). Соответственно, водные мостики не могут иметь принципиального значения для стабильности тройной спирали. Как же тогда 4R-гидроксилирование остатков Pro в Yaa-положении стабилизирует тройную спираль?
Неуклюжий эффект Замена Hyp в положении Yaa на (2S,4S)-4-фторпролин (flp), диастереомером Flp, предотвращает образование тройной спирали (таблица 2). Это открытие, что стереохимия электроотрицательных заместителей в положении 4 кольца Pro важна для образования стабильных тройных спиралей, предполагает, что Flp и Hyp в положении Yaa стабилизируют коллаген посредством стереоэлектронного эффекта, а не простого индукционного эффекта Pro и его производные предпочитают одну из двух основных складок пирролидинового кольца, которые называются Cγ-экзо и Cγ-эндо (рис. 7).
Кольцо на самом деле предпочитает две различные скрученные конформации, а не конвертирующие конформации. Поскольку Cγ испытывает большое смещение вне плоскости в скрученных кольцах, мы называем пирролидиновые кольцевые складки просто Cγ-экзо и Cγ-эндо.] Pro сам по себе отдает небольшое предпочтение кольцевой складке Cγ-эндо (таблица 3). Ключевым признаком фторогруппы 4R на Pro (а также природной гидроксильной группы 4R) является наложение Cγ-экзоскладки на пирролидиновое кольцо посредством эффекта гоша (рис. 8a,b). Кольцевая складка Cγ-exo предварительно организует торсионные углы главной цепи (φ, C′i−1–Ni–Cαi–C′i; ψ, Ni–Cαi–C′i–Ni+1; и ω, Cαi–C ′i–Ni+1–Cαi+1) на находящиеся в положении Yaa тройной спирали (табл. 4). Таким образом, 4R-гидроксилирование остатков Pro в положении Yaa коллагена стабилизирует тройную спираль за счет стереоэлектронного эффекта. Flp является более стабилизирующим, чем Hyp, поскольку фтор (χF = 4,0) более электроотрицателен, чем кислород (χO = 3,5), а группа фтора (FF = 0,45) проявляет больший индуктивный эффект, чем гидроксильная группа (FOH = 0,33). Таким образом, фторсодержащая группа 4R усиливает складку Cγ-экзо кольца производного Pro сильнее, чем гидроксильная группа 4R.
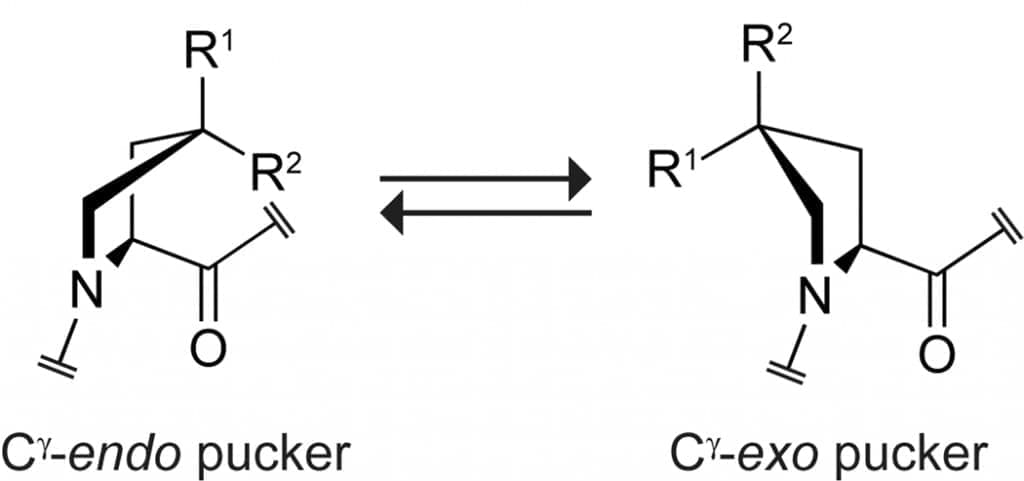
Рисунок 7. Кольцевые конформации производных Pro и Pro. Конформации Cγ-эндо сильно способствуют стереоэлектронные эффекты, когда R1 = H, R2 = F (flp) или Cl (clp), и стерические эффекты, когда R1 = Me (mep) или SH (mcp), R2 = H. Cγ-экзоконформации сильно способствуют стереоэлектронные эффекты, когда R1 = OH (Hyp), F (Flp), OMe (Mop) или Cl (Clp), R2 = H, и стерические эффекты, когда R1 = H, R2 = Me (Mep) или SH (Mcp). Отношение Cγ-эндо:Cγ-экзо составляет ~ 2, когда R1 = R2 = H.