Блуждающий нерв (БН) является самым длинным черепным нервом, иннервирующим шею, грудную клетку и брюшную полость, с афферентными волокнами, передающими ряд интероцептивных стимулов, и эфферентными волокнами к соматическим структурам и вегетативным преганглиям. За последние несколько десятилетий была разработана электрическая стимуляция БН с использованием имплантированных устройств (ВНС), что привело к ее одобрению для лечения эпилепсии и депрессии.
Анатомия блуждающего нерва
Стимуляция блуждающего нерва на протяжении многих лет играет ключевую роль в управлении психическим здоровьем человека.В этом обзоре рассматривается доклиническая и клиническая литература, касающаяся стимуляции блуждающего нерва. Коротко дана историческая перспектива, после чего рассматривается эффективность различных клинических применений электростимуляции нервус вагуса. Наконец, что известно о механизме, с помощью которого СНВ оказывает благотворное влияние на клиническое состояние пациента. Делается вывод, что хотя точный механизм действия СНВ до сих пор неизвестен, поиск механизма может дать новое понимание невропатологии депрессии. Это важно, чтобы предварительные предположения о влиянии СНВ на определенные аспекты функции мозга не ограничивали исследования. В 1930 г. Эрлангер и Гассер (1930) описали физические и электрические свойства проводимости A, B и С-волокок в черепных нервах.
Совсем недавно были разработаны неинвазивные устройства для стимуляции БН. Блуждающий нерв выполняет множество функций, и наиболее поддающейся оценке активностью является ее влияние на регуляцию сердечного ритма. Это можно легко оценить, измерив вариабельность сердечного ритма (ВСР). Снижение ВСР является результатом более слабого парасимпатического тонуса блуждающего нерва и связано с широким спектром нездоровья, включая более высокий риск ранней смертности. Было показано, что у людей с эпилепсией, особенно с плохо контролируемыми приступами, нарушен парасимпатический тонус.
Итак, могут ли естественные способы стимуляции БН, улучшить парасимпатический тонус, на что указывает повышение ВСР, улучшать контроль над приступами? Существует множество естественных способов стимуляции БН, улучшения ВСР и, следовательно, парасимпатического тонуса. Эти естественные способы делятся в основном на 3 категории: снижение стресса, физические упражнения и питание. Хотя было показано, что естественные способы стимуляции ВН повышают ВСР, они не уменьшают судороги. Исключением является прослушивание музыки Моцарта, которая, как было показано, повышает парасимпатический тонус и уменьшает судороги. Ясно, что требуется гораздо больше работы, чтобы изучить влияние различных способов повышения ВСР на возникновение припадков.
ВВЕДЕНИЕ
Блуждающий нерв (БН) — это 10-й черепной нерв и самый длинный черепной нерв, берущий начало в продолговатом мозге и выходящий из черепа через яремное отверстие, иннервирующий структуры шеи, грудной клетки и брюшной полости. Он участвует в вегетативной, сердечно-сосудистой, дыхательной, желудочно-кишечной, иммунной и эндокринной системах. Афференты блуждающего нерва воспринимают различные интероцептивные стимулы, включая давление, боль, растяжение, температуру, химическое, осмотическое давление и воспаление. Эфферентные пути блуждающего нерва иннервируют как соматические структуры, так и вегетативную нервную систему с волокнами как симпатических, так и парасимпатических преганглий. Большинство волокон ВН (60-80%) являются афферентными волокнами от внутренних органов.Электрическая стимуляция БН (ВНС) была впервые испытана в конце 19 века американским неврологом Джеймсом Корнингом. Он не смог продемонстрировать влияние на судороги. Корнинг предположил, что ВНС влияет на мозговой кровоток, который в то время считался причиной эпилепсии. К 1952 г. у животных было показано, что VNS влияет на электрические токи в БН и вызывает изменения на ЭКГ. Последующие исследования на животных способствовали лучшему пониманию VNS, и это привело к исследованиям на людях. В 1994 году рандомизированное многоцентровое двойное слепое исследование с участием 67 человек с рефрактерными припадками показало значительное снижение частоты припадков курс лечения 14 недель VNS.
Могут ли естественные способы стимуляции блуждающего нерва улучшить контроль над приступами?
Нервус вагус находится в ЦНС в мозговом веществе. Ядро блуждающего нерва вносит свои волокна в два других черепно-мозговых нерва: языкоглоточный (черепной IX) и добавочный нерв (черепной XI). Дорсальное двигательное ядро блуждающего нерва дает начало висцеромоторному эфференту компонента блуждающего нерва (Gray, 1918).Традиционно блуждающий нерв считался парасимпатическим эфферентным нервом, который контролирует и регулирует вегетативные функции, такие как частота сердечных сокращений и тонус желудка. Этот взгляд на блуждающий нерв изменился в 1938 г. после наблюдений, что электростимуляция блуждающего нерва приводит к изменениям в ЭЭГ (Bailey and Bremer, 1938), и в настоящее время принято считать, что он представляет собой смешанный нерв, 80% волокон которого несут афферентную (сенсорную) информацию и 20% несут эфферентную (двигательную) информацию (Foley and DuBois, 1937; Джордж и др., 2000).
Рисунок 1. Микроскопия блуждающего нерва
Сердечно-сосудистые эфференты блуждающего нерва регулируют частоту сердечных сокращений и артериальное давление, однако в этом отношении, правый и левый блуждающие нервы различаются. Правый vagus иннервирует синоатриальный узел (участвующий в пейсмекерной функция сердца).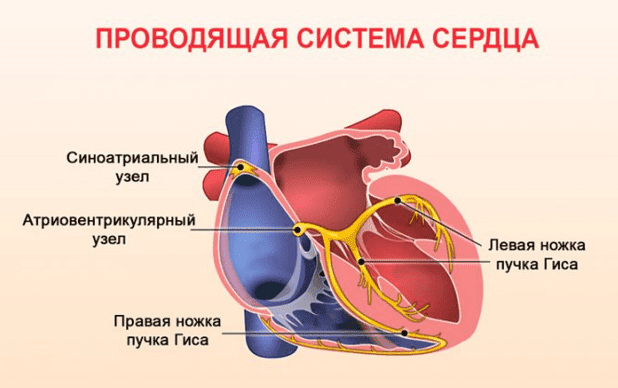
Левый блуждающий нерв инервирует атриовентрикулярный узел (регулируя силу сокращения сердечной мышцы в зависимости от объема крови, возвращающуюся к сердцу, с меньшим влиянием на поднятие частоты сердечных сокращений). Рэндалл и Арделл 1985 доказали это на экспериментах с собаками, что стимуляция правого блуждающего нерва, по сравнению с левым, вызвало большее снижение частоты сердечных сокращений и Вудбери в 1990 году сообщил, что высокий уровень стимуляции левого блуждающего нерва не влиял на частоту сердечных сокращений, но была остановка дыхания примерно за 1 с до возврата к исходному уровню в течение нескольких секунд.
Тела сенсорных афферентных клеток, находящиеся в узловатых и яремных ганглиях, проецируются на ядро солитарного тракта (NTS), оканчивающийся топографически, это приводит к функциональным изменениям NTS (Майер и др., 1998). Прямые и косвенные прогнозы от NTS в области мозга, над которыми проходит блуждающий нерв широко распространены. В последнее время данные функциональной визуализации (см. Barnes et al., 2003) дополнили традиционные анатомические исследования, чтобы обеспечить всестороннее изучение центральной нервной системы и зон влияния блуждающего нерва.
Электростимуляция блуждающего нерва (ВНС) является одобренным методом лечения эпилепсии и в настоящее время изучается как терапия других расстройств, включая депрессию, тревогу и болезнь Альцгеймера
Большинство волокон блуждающего нерва относятся к С-волокнам
Вудбери и Вудбери (1990) приводили оценку блуждающего нерва у кошек и выявили, что у 65–80% это С волокна. Американский невролог Джеймс Л. Корнинг (1855–1923), Ланска (2002) описал этот эффект как загадочная и противоречивая фигура (Lanska, 2002, стр. 452). Ланска (2002) заметил, что после несколько значительных научный работ Corning остался непризнанным, среди них его разработка примитивного устройства для стимуляции блуждающего нерва для подавления судорог.Корнинг считал, что судороги вызываются «венозным застоем» и ручная компрессия сонной артерии исправит это, таким образом подавляя судороги, путем снижения частоты сердечных сокращений и снижения сердечного выброса (Корнинг, 1883 г.). Хотя Корнинг сообщал, что эта форма стимуляции нервус вагуса была чрезвычайно эффективной для подавления припадков, его открытие не было широко принято его современниками и было почти забыто на целое столетие (Lanska, 2002).
К 1938 году Бейли и Бремер осознали потенциал стимуляции блуждающего нерва для лучшего функционирования центральной нервной системы, а не ее косвенного физиологического эффекта, который предполагался компанией Corning. Они сообщили, что у кошки стимуляция нервус вагуса вызывал синхронизированную активность орбитальной коры. Маклин и Прибрам (цит. по MacLean, 1990) в 1949 г. применил ВНС к анестезировнию приматов и сообщили, что стимуляция нервус вагуса вызывала генерацию медленной волны латеральной лобной коры.
В 1951 г., Делл и Олсон (цит. по George et al., 2000) сообщили что электрическая стимуляция перерезанного блуждающего нерва вызвала реакции в вентропо-заднем комплексе и интраламинарной области таламуса у бодрствующей кошки. В 1985 году Забара рассуждал, исходя из того, что было известно об анатомии из более ранних отчетов, что ВНС применялся для клинического контроля эпилепсии. Он предположил, что стимуляция нервус вагуса не только ослабляла двигательные припадки вызванные стрихнином, но и тремор, вызванный пентилентетразолом у собак, но также оказывало благотворное влияние на подавление припадков пережившых острую стимуляцию (Zabara, 1992).
Первый зарегистрированный имплант устройства стимуляции нервуса вагуса в человека при лечении хронического ВНС при лекарственно-устойчивой эпилепсии был установлен в 1988 г. (Penry and Dean, 1990 г.) и вскоре за этим последовало распространённая практика вживления человеческих имплантатов (Рутецкий, 1990; Пенри и Дин, 1990).
МЕХАНИЗМ СТИМУЛЯЦИИ БЛУЖДАЮЩЕГО НЕРВА
Точный механизм действия ВНС до конца не изучен. Он имеет множество эффектов, которые могут сами по себе, но, скорее всего, в сочетании с другими, проявлять наблюдаемые противосудорожные свойства. Эти эффекты включают десинхронизацию активности нейронов, пластичность гиппокампа, противовоспалительное действие и модуляцию высвобождения нейромедиаторов. БН воспринимает периферическое воспаление, и сигналы, передаваемые в ствол мозга, затем, в свою очередь, генерируют потенциалы действия, переносимые эфферентными волокнами БН в селезенку, где происходит выработка провоспалительных цитокинов. Это было названо воспалительным рефлексом. СБН может активировать этот рефлекс.Используя модель крыс с эндотоксемией, противовоспалительный эффект вызывали трансаурикулярной стимуляцией аурикулярной ветви БН. Исследование показало, что трансаурикулярная стимуляция снижает уровни воспалительных цитокинов в сыворотке, таких как TNF-α, IL-1β и IL-6, а также провоспалительного фактора транскрипции NF-κB. Эти противовоспалительные эффекты устранялись ваготомией или введением антагониста α7nAChR (никотинового ацетилхолинового рецептора). Действительно, ряд исследований с использованием животных моделей при воспалительных заболеваний продемонстрировал благотворное влияние СБН.
Таким образом, СБН, вероятно, проявляет свои противосудорожные эффекты за счет комбинации ряда эффектов центральной нервной системы и периферических противовоспалительных эффектов. СБН может вызвать системное высвобождение катехоламинов, которые могут облегчить приступы астмы. Он индуцирует антиноцицепцию, модулируя многочисленные связанные с болью структуры в головном и спинном мозге, влияя на периферическую/центральную ноцицепцию, реакцию на опиоиды, воспалительный процесс и поведение, связанное с болью. В настоящее время СБН проходит множество испытаний для изучения его потенциала в отношении различных других клинических расстройств: головной боли, артрита, астмы, боли, фибромиалгии, биполярного расстройства и деменции.
ОЦЕНКА ФУНКЦИИ БЛУЖДАЮЩЕГО НЕРВА
ВН представляет собой комплекс с афферентами, воспринимающими различные интероцептивные стимулы, эфферентами к вегетативной нервной системе и соматическими структурами, включая большинство мышц глотки и гортани. Хотя ВН выполняет множество функций, его роль в создании парасимпатического тонуса занимает центральное место в нашем обсуждении. Парасимпатический тонус блуждающего нерва модулируется возбуждающим сигналом от барорецепторов, хеморецепторов, рецепторов тройничного нерва. Активность блуждающего нерва можно оценить, исследуя его влияние на сердце с помощью различных процедур.Вегетативные функциональные тесты
К ним относятся глубокое дыхание, маневр Вальсальвы, изометрические упражнения, холодовой прессор и тест с наклонным столом. Изменения частоты сердечных сокращений и артериального давления во время тестов позволяют оценить симпатическую и парасимпатическую реактивность. Эти тесты используются крайне редко и в значительной степени заменены показателями вариабельности сердечного ритма (ВСР).ВСР с использованием электрокардиограммы (ЭКГ)
Последовательные интервалы R-R получают из непрерывных записей ЭКГ. Они обеспечивают мгновенную частоту сердечных сокращений, которые используются для расчета ВСР. ВСР зависит главным образом от влияния симпатической и вагусной активности на синусовый узел. Существует множество способов анализа записей ЭКГ для определения ВСР. Хотя есть некоторый консенсус в отношении интерпретации результатов. Двумя основными наиболее часто используемыми методами являются оценка параметров во временной области и оценка параметров в частотной области. При анализе во временной области ВСР обычно оценивают путем определения SDNN (SD интервалов R-R); однако можно использовать и другие меры, включая SDANN (SD средних интервалов R–R), RMSSD (среднеквадратичное значение последовательных разностей) и треугольный индекс ВСР. При анализе частотной области большинство исследований показывают, что высокочастотные (ВЧ) компоненты отражают парасимпатический тонус, в то время как низкочастотные (НЧ) компоненты, как считается, имеют как симпатические, так и парасимпатические влияния, а отношения НЧ/ВЧ, как полагают, отражают симпато-вагальный баланс или симпатические модуляции.В исследовании, анализирующем 24-часовые записи ЭКГ детей, все измерения во временной и частотной областях значительно коррелировали друг с другом. Однако были различия в силе корреляций. Все показатели во временной области более тесно коррелировали с ВЧ-компонентами, чем с НЧ-компонентами, что свидетельствует о том, что увеличение ВСР (оцениваемое с помощью измерений во временной области) обычно подразумевает большее увеличение ВЧ-компонентов и, следовательно, парасимпатического тонуса, чем симпатического тонуса. Таким образом, маркерами вегетативной функции и в частности тонуса парасимпатической системы принято считать следующие параметры ВСР: SDNN, RMSSD, общая мощность и мощность ВЧ.
Использование технологии фотоплетизмографии (ФПГ)
PPG использует оптический датчик, прикрепленный к мочке уха или пальцу, для обнаружения сердечной пульсовой волны путем обнаружения изменений в поглощении света вследствие изменений количества молекул гемоглобина в коже во время пульсовой волны. Было показано, что ВСР, полученная из ФПГ, сильно коррелирует с ВСР, полученной с помощью ЭКГ, и может использоваться для оценки тонуса блуждающего нерва. Существует ряд общедоступных устройств, использующих технологию PPG, например. emWave2 от HeartMath для использования с домашними компьютерами и Inner Balance для использования с устройствами Apple Inc. Недавно технология PPG была реализована в мобильных устройствах с использованием камер в качестве оптических датчиков, что сделало домашний мониторинг тонуса блуждающего нерва очень простым и доступным. Кроме того, было показано, что максимальная вариация частоты сердечных сокращений (самая большая респираторная синусовая аритмия, также показатель ВСР) во время 1-минутного теста на глубокое дыхание показала лучшую корреляцию с возрастом по сравнению с параметрами, полученными из 5-минутных записей ВСР. Следовательно, можно использовать довольно простой алгоритм для определения тонуса блуждающего нерва с поправкой на возраст.В целом, высокая ВСР указывает на преобладание парасимпатической нервной системы/тонуса блуждающего нерва, стороны вегетативной нервной системы, которая способствует расслаблению, пищеварению, сон и восстановление. Парасимпатическая система также известна как система «кормить и размножаться» или «отдыхать и переваривать». Низкая ВСР указывает на доминирование симпатической нервной системы, на сторону борьбы или бегства вегетативной нервной системы, связанную со стрессом, перетренированностью и воспалением.
Параметры стимуляции
Существует ряд переменных, которые можно настроить в клинике, чтобы адаптировать стимуляцию для пациента: сила тока; ширина импульса; частота; продолжительность. Периоды включения и выключения можно легко изменять и регулировать. Когда стимулирующее устройство впервые активируется у пациента, как правило, используются только низкие параметры стимуляции. Допустимый ток (0, 25–0, 75 мА) (DeGiorgio et al., 2000), параметры стимуляции увеличиваются постепенно; при превышении индикации выше максимально допустимого уровня сразу становится очевидным, так как пациент сообщает о боли или его начинают мучать приступы кашля. В таком случае стимулирующее устройство нужно снизить на максимально «комфортное» значение.В экспериментальной литературе представлен широкий спектр стимуляций. Сообщают что ток от 0, 2 мА (предназначен для активации А-волокок) до 3,0 мА (сверхмаксимальный для А-, В- и С-волокон). Эффективные параметры частоты тока при стимуляции, используемые в клинике исходят из экспериментальных исследований. Агнью и McCreey (1990) исследовал влияние ряда разных частот и показал, что стимуляция частотой 50 Гц и выше вызывали серьезные необратимые повреждения блуждающего нерва. Следуя этим наблюдениям, что было подтверждено другими испытаниями (Вудбери и Вудбери, 1990, 1991; Zabara, 1992)
FDA одобрила частоты стимуляции от 20 до 30 Гц для клинического использования
Они пришли к выводу: что «противоэпилептическая активность напрямую связана с выделяющими фракциями после стимулирования С-волокон блуждающего нерва». Однако это заключение требует пересмотра, так как подавление припадков наблюдается у крыс даже после селективного, индуцированного капсаицином, разрушения С-волокон (Krahl et al., 2001). Более того, параметры стимуляции, клинически эффективные для подавление припадков ниже тех, которые могли бы задействовать С-волокна (Koo et al., 2001). Наконец, Чейз и др. (1966) отметили немедленное (в течение 1 или 2 с) начало гиппокампального тета-ритма на уровне стимуляции, который не задействует С-волокна, но который индуцируют корковую синхронию. Эти исследования показывают, что активация С-волокон не требуется для индуцирования тета-ритма гиппокампа или для подавление приступов. Кроме того, они указывают положительный эффект от низкого и высокого уровня стимуляции блуждающего нерва, что может вызывать различные центральные последствия.
Клинические предположения
Cyberonics, Inc. предложил, что СБН имеет потенциал для лечения большого количества клинических состояний, включая парциальную комплексную эпилепсию, генерализованную эпилепсию, непроизвольные двигательные расстройства, депрессию, мигрень и нервно-психические расстройства.Zabara (1992) предположил, что стимуляция вегетативного нерва оказывает быстрое купирование приступа, а также рекомендовано при хронической форме, таким образом, продолжительное лечение СБН приводит к торможению судорожной активности и, следовательно, снижает вероятность приступов. Моррис и Мюллер (1999) представили данные подтверждающие вывод, что эффективность стимуляции блуждающего нерва повышается со временем. Они проанализировали долгосрочные эффекты СБН у пациентов, которые участвовали в трех исследованиях эпилепсии. Общий размер группы составил 454 пациента. Пациенты сообщили о 50% или более снижение частоты приступов. Результаты показали что в течение 3-летнего периода количество респондентов стабильно повышалось. Несмотря на этот эффект, Cyberonics, Inc., рекомендуют, если снижение частоты приступов на 50% не наблюдается через 18 месяцев, устройство деактивируется и снимается.
Депрессия
Значительное улучшение настроения, независимое от судорожной активности у пациентов с эпилепсией, получающих СБН было отмечено Elger et al. (2000), который предположил, что дальнейшие исследования должны изучать использование СБН в качестве терапии депрессии. Первое исследование эффектов СБН у пациентов с депрессией опубликовал Rush и другие (2000). У 30 пациентов в анамнезе не было эпилепсии, и все они имели диагноз большое депрессивное расстройство. Все они перенесли четыре или более серьезных депрессивных эпизодов в течение жизни и имели текущий депрессивный эпизод, который не вылечивался.У двенадцати пациентов (40%) наблюдалось улучшение в настроении после всего десяти недель СБН. Эти данные побудило FDA США одобрить годичный клинический эксперимент под руководством доктора Л. Марангелла, чтобы исследовать 30 пациентов в течение дополнительных 9 месяцев. Скорость отклика на терапию был у 40% пациентов, первоначально сообщалось Rush et al. (2000) терапевтический эффект сохранялся в течение длительного периода времени. Марангелл и др. (2002) пришел к выводу, что СБН оказывает устойчивую симптоматическую пользу через один год и что требуются дополнительные клинические исследования на более крупной когорте пациентов.
В 1997 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило имплантируемое левое шейное электро-стимулирующее устройство для лечения резистентной (к препаратамм) к лечению эпилепсии, а впоследствии, в 2005 г., одобрило его использование для лечения хронической резистентной к лечению депрессии. Устройство СБН также получило в 2015 году европейское одобрение для лечения хронической сердечной недостаточности. Это одобрение было основано на открытом исследовании с участием 60 человек с тяжелой сердечной недостаточностью, которое показало значительное улучшение ряда показателей сердечной функции.
Совсем недавно были разработаны неинвазивные устройства СБН. Трансаурикулярное устройство СБН является одним из таких неинвазивных устройств, которое стимулирует аурикулярную ветвь БН. Оно было одобрено в Европе для лечения эпилепсии и депрессии в 2010 году, а также боли в 2012 году. Шейное устройство СБН, которое стимулирует шейную ветвь БН, получило европейское разрешение для использования в ряде состояний, включая острое и профилактическое лечение первичных головных болей, головной боли, связанной с чрезмерным использованием лекарств, реактивных заболеваний дыхательных путей, а также соединительная терапия эпилепсии, для предотвращения и уменьшения симптомов некоторых тревожных и депрессивных состояний, нарушений подвижности желудка и синдрома раздраженного кишечника.
СНИЖЕНИЕ ПАРАСИМПАТИЧЕСКОГО ТОНУСА У ЛЮДЕЙ С ЭПИЛЕПСИЕЙ
В метаанализе, включающем 39 исследований, у людей с эпилепсией были значительно более низкие показатели HF, SDNN, RMSSD по сравнению с контрольной группой. Это подтверждает предположение о том, что эпилепсия связана с симпатовагальным дисбалансом, со снижением парасимпатического тонуса . В исследовании, в котором оценивали 19 пациентов с рефрактерной эпилепсией, RMSSD использовали в качестве меры для ВСР. Затем RMSSD коррелировали с инвентаризацией SUDEP-7, которая представляет собой показатель, отражающий тяжесть эпилепсии — количество припадков, продолжительность эпилепсии и количество используемых противоэпилептических препаратов. В исследовании была обнаружена значительная обратная корреляция между показателями RMSSD и SUDEP-7, что свидетельствует о том, что более тяжелая форма эпилепсии связана с ухудшением парасимпатической вегетативной функции.В другом исследовании с участием 61 человека у пациентов с трудноизлечимой эпилепсией был более высокий симпатический и более низкий парасимпатический тонус по сравнению с пациентами с хорошо контролируемой эпилепсией . Следовательно, есть убедительные доказательства того, что у людей с эпилепсией более низкий парасимпатический тонус, который еще более нарушен у людей с тяжелой эпилепсией.
СНИЖЕНИЕ ПАРАСИМПАТИЧЕСКОГО ТОНУСА ПРИ ДРУГИХ ЗАБОЛЕВАНИЯХ
В проспективном исследовании риска атеросклероза в сообществах, в котором приняли участие 12 162 человека, один из исходов показал, что низкая ВСР была связана с повышенным риском болезни Паркинсона. Используя ВСР в качестве меры активности ВН, в ряде исследований была показана связь между плохой активностью БН и воспалительными состояниями, такими как ревматоидный артрит, атеросклероз и болезнь Крона. В исследовании с участием 1882 человек в возрасте от 21 до 76 лет снижение ВСР было определено как значимый предиктор развития диабета, сердечно-сосудистых заболеваний и ранней смертности. Низкая ВСР связана с широким спектром заболеваний и даже связана с повышенным риском ранней смертности.ВЛИЯНИЕ ВНС НА ПАРАСИМПАТИЧЕСКИЙ ТОНУС ВАГУСА
Было проведено исследование с участием 48 здоровых участников. После чрескожной электрической аурикулярной стимуляции ВН (tVNS) были проведены измерения ВСР и микронейрографические записи. Исследование показало, что активная tVNS значительно увеличивала ВСР, указывая на сдвиг вегетативной функции сердца в сторону преобладания парасимпатической. Микронейрографические записи показали значительное снижение частоты и частоты активности мышечных симпатических нервов. Исследование показало, что tVNS может повышать ВСР и уменьшать отток симпатического нерва.В исследовании, включавшем 9 человек с рефрактерной эпилепсией, начало или возобновление ВНС после замены батареи было связано со значительным снижением LF и отношения LF:HF, что указывает на изменение вегетативного баланса в пользу доминирования парасимпатической нервной системы. И наоборот, в ряде исследований не показано изменений ВСР после ВНС. В одном конкретном исследовании с участием 17 детей в возрасте 3-16 лет сообщалось, что VNS повышает симпатический тонус во время сна. Некоторые исследования показали различные эффекты на ВСР в зависимости от условий стимуляции и показывающие межиндивидуальные различия. Таким образом, проведенные до сих пор исследования не дают четкого представления о влиянии ВНС на ВСР. Дальнейшая работа в этом направлении необходимо для полного понимания влияния ВНС на вегетативную нервную систему.
Беспокойство и тревога
Chavel et al. (2003) сообщал о снижение тревожности у пациентов с эпилепсией, получавших стимуляцию блуждающего нерва. Это снижение коррелировало со снижением частоты приступов, и, следовательно, это может быть использовано как вторичная, психологическая, польза при лечении подобных больных. Это согласуется с предыдущими сообщениями о терапевтической пользе СБН при тревоге.Давно известно, что во время тревоги вовлекается блуждающий нерв. Теория эмоций Джемса-Ланге утверждает, что переживание эмоции зависит от восприятие вегетативных сигналов. Современный взгляд, во многом основанный на работах Шактера и Зингер в 1960-е годы (например, Шактер и Зингер, 1962), подчеркивает важность когнитивной интерпретации, исходя из контекста, но не отклоняет важность восприятия вегетативного возбуждения. Таким образом, сигналы вегетативного возбуждения передаются по блуждающему нерву в мозг, где возбуждение интерпретируется как эмоциональный срыв.
Как отмечалось выше, Chavel et al. (2003) сообщили, что пациенты, реагирующие на СБН при эпилепсии также значительно меньше испытывали беспокойство. Раш и др. (2000) отметили, что СБН меняет показатель «качества жизни» у тревожных пациентов, получающих подобное лечение. Из 30 пациентов с депрессией, оцененные Rush et al. (2000), девять также страдали возбуждением, 10 сообщили о психическом беспокойстве и 11 сообщили о соматической тревоге. Все эти пациенты испытывали некоторое улучшение: среднее улучшение возбуждения было 73%; среднее улучшение психической тревожности составило 50%; среднее улучшение соматической тревожности составило 36%. Эти наводящие на размышления результаты привели к утверждению многоцентрового открытого исследования СБН как средства лечения тревоги, которое началось в 2001 г.
В исследовании приняли участие 10 пациентов (средний возраст 38 лет), которые страдали обсессивно-компульсивным расстройством, посттравматическим стрессовым расстройством и паническим расстройством. Через 10 недель все пациенты сообщили об улучшении состояния. Среднее снижение по шкале тревоги Гамильтона (HAM-A) составило 23% (George et al., 2003).
Возможные механизмы
Имеются убедительные доказательства того, что СБН изменяет функцию мозга прямым афферентным действием, а не косвенно через эффекты эфферентных проекций. Пути по которым СБН оказывает различные эффекты еще плохо изучены. Существует растущий объем доказательств в пользу норадреналина. Было показано, что СБН приводит к длительному (более чем 80 мин) увеличение выброса норадреналина в базолатеральной миндалине, происхождение которой может быть очагом coeruleus, самая большая популяция норадренергических нейронов в головном мозге и в получении проекций от ядра одиночного тракта (Van Bockstaele et al., 1999), таким образом происходит модуляция блуждающего нерва. В качестве альтернативы также возможно, что норадреналин в миндалевидном теле увеличивается при прямой проекции норадренергических нейронов ядра одиночного тракта (группа норадренергических клеток А2), который стимулирует миндалевидное тело (Herbert and Saper, 1992), а также голубое пятно.Крал и др. в 1998 году продемонстрировали, что голубое пятно играет ключевую роль в модулировании эффектов ослабления припадков, показав на крысах, что поражения препятствуют способности блуждающего нерва для подавления судорог, вызванных шоком роговицы. Кроме того, прямая электрическая стимуляция локуса coeruleus ингибировала развитие киндинга, продуцируемого с помощью электрической стимуляции миндалевидного тела (Хименес-Ривера и др., 1987). В совокупности эти доказательства согласуются с предположением, что голубое пятно опосредует, по крайней мере, некоторые эффекты СБН в ослаблении припадков.
Тем не менее, большая часть доказательств, связывающих норадреналин для СБН является косвенным явлением. Несомненно, разнообразные функции, в которых, как считается, участвует норадреналин перекрывают функции, в которых вовлечены СБН (в первую очередь, включая как эпилепсию, так и депрессия; обзор см. Jobe et al., 1999), однако это может быть связано с тем, что поиск приложений СБН сосредоточены на функциях норадреналина.
История биологической психиатрии и неврологии ясно указывает на то, что терапевтические преимущества многих неврологических вмешательств обнаруживаются случайно и используются в качестве лечения без полного (или, иногда) понимания механизма действия. Тем не менее, могут быть получены подсказки и достигнуты новые идеи когда исследование направлено на понимание быстрого эффекта СБН, что может быть важным толчком в поисках объяснения патогенеза депрессии и других расстройств, для которых терапевтический потенциал ВНС изучается. Это важно, чтобы этот поиск не был ограничен предшествующими предположения о влиянии ВНС на отдельные стороны работы мозга.
Блуждающий нерв и сердце
Парасимпатическая иннервация сердца осуществляется через блуждающий нерв. В частности, блуждающий нерв снижает частоту сердечных сокращений. Правый блуждающий нерв иннервирует синоатриальный узел. Парасимпатическая гиперстимуляция предрасполагает больных к брадиаритмиям. Левый блуждающий нерв при гиперстимуляции предрасполагает сердце к атриовентрикулярной (АВ) блокаде.В этом месте нейробиолог Отто Леви впервые доказал, что нервы выделяют вещества, называемые нейротрансмиттерами, которые воздействуют на рецепторы в тканях-мишенях. Леви описал вещество, выделяемое блуждающим нервом, как блуждающий нерв, которое, как позже выяснилось, было ацетилхолином. Блуждающий нерв имеет три ядра в ЦНС, связанных с сердечно-сосудистый контроль, дорсальное моторное ядро, двойное ядро и одиночное ядро. Парасимпатический выход к сердцу поступает в основном от нейронов двойного ядра и в меньшей степени от дорсального двигательного ядра. Одиночное ядро получает сенсорную информацию о состоянии сердечно-сосудистой системы, являясь интеграционным центром барорефлекса.
Препараты, ингибирующие мускариновые холинорецепторы (антихолинергические средства), такие как атропин и скополамин, называются ваголитическими, поскольку они ингибируют действие блуждающего нерва на сердце, желудочно-кишечный тракт и другие органы. Антихолинергические препараты увеличивают частоту сердечных сокращений и используются для лечения брадикардии (замедление сердечного ритма) и асистолии, когда сердце не имеет электрической активности.
Медикаментозное лечение блуждающего нерва
Стимуляция блуждающего нерва (VNS) с использованием устройства, похожего на кардиостимулятор, имплантированного в грудную клетку, - метод лечения, используемый с 1997 года для контроля судорог у пациентов с эпилепсией, и недавно был одобрен для лечения устойчивых к лекарствам случаев клинической депрессии. Неинвазивное устройство VNS, которое стимулирует афферентную ветвь блуждающего нерва, также разрабатывается и вскоре пройдет испытания.VNS также может быть достигнут одним из вагусных маневров: задержкой дыхания на несколько секунд, погружением лица в холодную воду, кашлем или напряжением мышц живота, как если бы они напрягались, чтобы вызвать дефекацию (проба Вальсальвы). Пациентов с суправентрикулярной тахикардией, фибрилляцией предсердий и другими заболеваниями можно обучить выполнять вагусные маневры (или самостоятельно находить один или несколько).
Блокада блуждающего нерва (VBLOC) аналогична VNS, но используется только в течение дня. В шестимесячном открытом исследовании с участием трех медицинских центров в Австралии, Мексике и Норвегии блокирование блуждающего нерва помогло 31 участнику, страдающему ожирением, сбросить в среднем почти 15 процентов избыточного веса. Начались годичные двойные слепые испытания фазы II с участием 300 человек.
Ваготомия (пересечение блуждающего нерва) — ныне устаревший метод лечения язвенной болезни. В настоящее время ваготомия исследуется как менее инвазивная процедура по снижению веса, альтернативная операции обходного желудочного анастомоза. Процедура сдерживает чувство голода и иногда проводится в сочетании с наложением бандажей на живот пациентов, что приводит к средней потере веса на 43% за шесть месяцев с помощью диеты и физических упражнений.
Одним из серьезных побочных эффектов ваготомии является дефицит витамина B12 в более позднем возрасте, что похоже на пернициозную анемию. С возрастом желудок вырабатывает меньше кислоты. Кислота и один из ее компонентов, называемый внутренним фактором, необходимы для метаболизма B12 из пищи. Ваготомия уменьшает количество кислоты, что в конечном итоге приводит к дефициту, который, если его не лечить, вызывает повреждение нервов, усталость, слабоумие, паранойю и, в конечном итоге, смерть.
Физические и эмоциональные эффекты
Активация блуждающего нерва обычно приводит к снижению частоты сердечных сокращений, артериального давления или того и другого. Это обычно происходит на фоне желудочно-кишечных заболеваний, таких как вирусный гастроэнтерит или острый холецистит, или в ответ на другие раздражители, включая массаж каротидного синуса, пробу Вальсальвы или боль по любой причине, особенно при заборе крови. Когда изменения кровообращения достаточно велики, возникает вазовагальный обморок. Относительное обезвоживание имеет тенденцию усиливать эти реакции.Чрезмерная активация блуждающего нерва во время эмоционального стресса, которая является парасимпатической сверхкомпенсацией сильной реакции симпатической нервной системы, связанной со стрессом, также может вызвать вазовагальный обморок из-за внезапного падения артериального давления и частоты сердечных сокращений. Вазовагальный обморок чаще поражает детей раннего возраста и женщин. Это также может привести к временной потере контроля над мочевым пузырем в моменты сильного страха. Исследования показали, что женщины с полным пересечением спинного мозга могут испытывать оргазм через блуждающий нерв, который может идти от матки, шейки матки и, возможно, влагалища к мозгу.

